题目内容
(14分)(1)在配合物Fe(SCN)2+中,提供空轨道接受孤对电子的微粒是_________ __,[Cu(H2O)4]2+名称为 ,画出该配离子中的配位键__________ _______ 。
(2)根据VSEPR预测HCN的空间结构为 形,其中C原子用于形成σ键的是 个 轨道,用于形成π键的是 个 轨道。
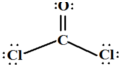
(3)根据甲醛的分子结构特点推测俗称光气的二氯甲醛分子(COCl2)结构式为 ,中心原子杂化方式为 ,空间结构为 形。
(4)按要求写出仅由第三周期非金属元素的原子构成且中心原子通过sp3杂化形成分子的化学式(各写一种):
正四面体分子____ _,三角锥形分子____ ____,V形分子___ __ _ ___。
(14分)(1)Fe3+(1分),
四水合铜离子(1分),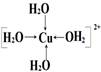 (1分)
(1分)
(2)直线(1分),2(1分),SP杂化(1分),2(1分),未杂化的P轨道(1分)
(3)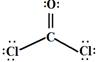 (1分),SP2(1分),平面三角(1分)
(1分),SP2(1分),平面三角(1分)
(4)SiCl4(1分),PCl3(1分),SCl2(1分)
【解析】(1)根据配合物化学式可知,Fe(SCN)2+中提供空轨道接受孤对电子的微粒应该是铁离子;[Cu(H2O)4]2+名称为四水合铜离子,其中水是配体,铁离子提供空轨道,所以该配离子中的配位键是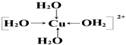 。
。
(2)化合物HCN中中心原子碳原子没有孤对电子,所以该化合物是直线型结构。其中C原子用于形成σ键的是2个sp杂化轨道;而未参与杂化的p轨道电子用于形成π键。
(3)二氯甲醛分子(COCl2)中中心碳原子也没有孤对电子,所以是平面三角形结构,因此是sp2杂化,其结构式是 。
。
(4)仅由第三周期非金属元素的原子构成且中心原子通过sp3杂化形成分子中,如果是正四面体形结构,则应该是SiCl4;如果是三角锥形结构,则应该是PCl3;如果是直线型结构,则应该是SCl2。

 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案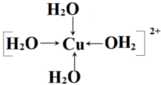
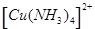 中的配位键 。
中的配位键 。 中的配位键 。
中的配位键 。