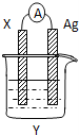
题目内容
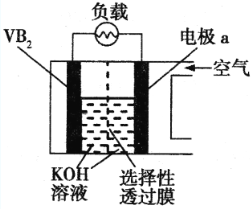
【题目】锌空气电池的电容量大,可作为汽车的清洁能源。总反应式为:2Zn+O2+2H2O=2Zn(OH)2。示意图如图所示:
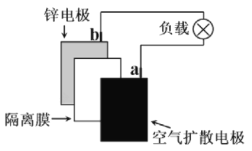
有关该电池的说法正确的是( )
A.电池可以用稀硫酸做电解质溶液
B.电池工作时,电子由a电极沿导线流向b电极
C.空气扩散电极上的电极反应:O2+2H2O+4e-=4OH-
D.阻隔空气进入锌--空气电池,电池停止工作
【答案】CD
【解析】
A. 若用稀硫酸做电解质溶液,锌与稀硫酸反应放出氢气,正极氢离子得电子生成氢气,故A错误;
B. 电池工作时,锌是负极,所以电子由b电极沿导线流向a电极,故B错误;
C. 空气扩散电极是正极,正极上氧气得电子生成氢氧根离子,电极反应是O2+2H2O+4e-=4OH-,故C正确;
D. 阻隔空气进入锌-空气电池,正极上缺少了氧气,电池停止工作,故D正确;
答案选CD。

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案【题目】元素周期表是学习化学的重要工具,它隐含着许多信息和规律。下表所列是五种短周期元素的原子半径及主要化合价(已知铍的原子半径为0.089 nm)。
元素代号 | A | B | C | D | E |
原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
主要化合价 | +2 | +3 | +6、-2 | -1 | -2 |
(1)用元素代号标出它们在周期表中所对应的位置(以下为周期表的一部分)_________。
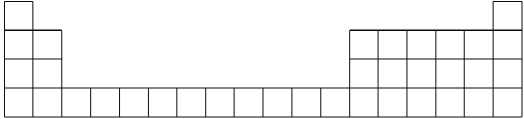
(2)画出A的原子结构示意图_________。
(3)B元素处于周期表中第________周期,________族。
(4)E元素处于周期表中第________周期,________族。
(5)C、D的简单离子的半径由大到小顺序为________(用离子符号表示)。
(6)上述五种元素的最高价氧化物对应的水化物中酸性最强的是__________(填化学式)。
(7)C、E形成的化合物为________(填化学式)。
(8)写出B单质和氢氧化钠溶液反应的方程式__________写出B的最高价氧化物对应水化物和氢氧化钠溶液反应的离子方程式:________
【题目】某化学兴趣小组在习题解析中看到:“SO2通入Ba(NO3)2溶液出现白色沉淀,是因为在酸性环境中,NO3-将SO32-氧化成SO42-而产生沉淀”。有同学对这个解析提出了质疑,“因没有隔绝空气,也许只是![]() 氧化了SO32-,与NO3-无关”。于是做了“SO2通入Ba(NO3)2溶液”的探究实验,用pH传感器检测反应的进行,实验装置如图。回答下列问题:
氧化了SO32-,与NO3-无关”。于是做了“SO2通入Ba(NO3)2溶液”的探究实验,用pH传感器检测反应的进行,实验装置如图。回答下列问题:

(1)仪器a的名称为__。
(2)实验小组发现装置C存在不足,不足之处是__。
(3)用0.1mol/LBaCl2溶液、0.1mol/LBa(NO3)2溶液、食用油,配制4种溶液(见下表)分别在装置C中进行探究实验。
编号 | ① | ② | ③ | ④ |
试剂 | 煮沸过的BaCl2溶液25mL,再加入食用油25mL | 未煮沸过的BaCl2溶液25mL | 煮沸过的Ba(NO3)2溶液25mL,再加入食用油25mL | 未煮沸过的Ba(NO3)2溶液25mL |
对比①、②号试剂,探究的目的是___。
(4)进行①号、③号实验前通氮气的目的是__。
(5)实验现象:①号依然澄清,②、③、④号均出现浑浊。第②号实验时C中反应的离子方程式为__。
(6)图1-4分别为①,②,③,④号实验所测pH随时间的变化曲线。
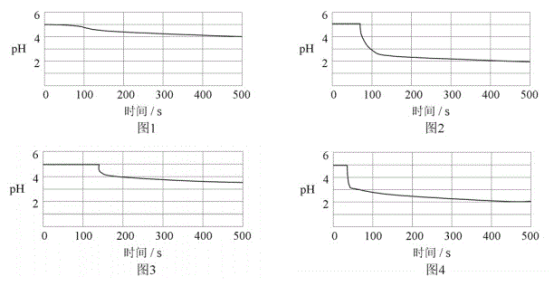
根据以上数据,可得到的结论是__。