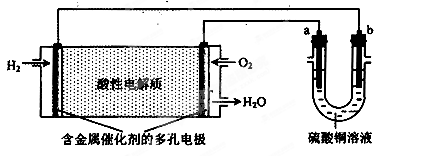
题目内容
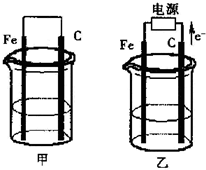
甲、乙两池电极材料都是铁棒与碳棒(如图).请回答下列问题:
(1)若两池中均盛放100ml0.1mol/LCuSO4溶液,反应一段时间后:
①当电路中通过0.01电子时,甲池中的______棒上析出Cu,其质量为______g.
②在乙池中阳极的电极反应式是______.
(2)若两池中均盛放100ml0.1mol/LNaCl溶液.
①写出甲池中正极的电极反应式______
②写出乙池中总反应的离子方程式______
③当电路通过0.01mol电子时,不考虑溶液体积变化,常温下乙池溶液的pH=______.
(1)若两池中均盛放100ml0.1mol/LCuSO4溶液,反应一段时间后:
①当电路中通过0.01电子时,甲池中的______棒上析出Cu,其质量为______g.
②在乙池中阳极的电极反应式是______.
(2)若两池中均盛放100ml0.1mol/LNaCl溶液.
①写出甲池中正极的电极反应式______
②写出乙池中总反应的离子方程式______
③当电路通过0.01mol电子时,不考虑溶液体积变化,常温下乙池溶液的pH=______.

(1)甲池为原电池装置,Fe为负极,电极反应为Fe-2e-=Fe2+,C为正极,发生还原反应,电极反应式为Cu2++2e-=Cu,乙装置为电解装置,根据电子移动的方向可知C为阳极,Fe为阴极,阳极反应为4OH-=O2↑+H2O+4e-,阴极反应为Cu2++2e-=Cu,
①当电路中通过0.01电子时,甲池中的C棒上析出铜,物质的量为0.005mol,质量为0.005mmol×64g/mol=0.32g,故答案为:碳;0.32;
②由以上分析可知,在乙池中阳极的电极反应式是4OH-=O2↑+H2O+4e-,故答案为:4OH-=O2↑+H2O+4e-;
(2)若两池中均盛放100ml0.1mol/L NaCl溶液,则甲池发生金属的腐蚀,正极为2H2O+O2+4e-4OH-,负极为为Fe-2e-=Fe2+,乙池为电解食盐水装置,阳极反应为O2+4e-+2H2O═4OH-,阴极反应为2H++2e-=H2↑,
①由以上分析可知,甲池中正极的电极反应式为2H2O+O2+4e-4OH-,故答案为:2H2O+O2+4e-4OH-;
②氯化钠溶液中存在的离子是:氯离子、氢氧根离子、钠离子、氢离子,氯离子的放电能力大于氢氧根离子,氢离子的放电能力大于钠离子,所以该反应的生成物是氯气、氢气、氢氧化钠,总反应式为2Cl-+2H2O
2OH-+H2+Cl2,
故答案为:2Cl-+2H2O
2OH-+H2↑+Cl2↑;
③当电路通过0.01mol电子时,不考虑溶液体积变化,乙池中c(OH-)=
=0.1mol/L,常温下乙池溶液的pH=13,
故答案为:13.
①当电路中通过0.01电子时,甲池中的C棒上析出铜,物质的量为0.005mol,质量为0.005mmol×64g/mol=0.32g,故答案为:碳;0.32;
②由以上分析可知,在乙池中阳极的电极反应式是4OH-=O2↑+H2O+4e-,故答案为:4OH-=O2↑+H2O+4e-;
(2)若两池中均盛放100ml0.1mol/L NaCl溶液,则甲池发生金属的腐蚀,正极为2H2O+O2+4e-4OH-,负极为为Fe-2e-=Fe2+,乙池为电解食盐水装置,阳极反应为O2+4e-+2H2O═4OH-,阴极反应为2H++2e-=H2↑,
①由以上分析可知,甲池中正极的电极反应式为2H2O+O2+4e-4OH-,故答案为:2H2O+O2+4e-4OH-;
②氯化钠溶液中存在的离子是:氯离子、氢氧根离子、钠离子、氢离子,氯离子的放电能力大于氢氧根离子,氢离子的放电能力大于钠离子,所以该反应的生成物是氯气、氢气、氢氧化钠,总反应式为2Cl-+2H2O
| ||
故答案为:2Cl-+2H2O
| ||
③当电路通过0.01mol电子时,不考虑溶液体积变化,乙池中c(OH-)=
| 0.01mol |
| 0.1L |
故答案为:13.

练习册系列答案
相关题目
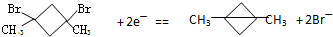
 是______极产物.
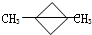
是______极产物.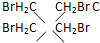 得到一种烃的电极方程式______.
得到一种烃的电极方程式______.