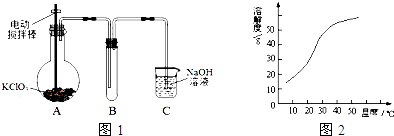
题目内容
20.以CH3OH为燃料(以KOH溶液作电解质溶液)可制成CH3OH燃烧电池,则充入O2的电极为正极,充入CH3OH电极的反应式为CH3OH+8OH--6e-=CO32-+6H2O.分析 甲醇燃料碱性电池中,加入燃料的电极是负极,负极上甲醇失电子和氢氧根离子反应生成碳酸根离子和水,正极上通入氧气,正极上氧气得电子和水反应生成氢氧根离子.
解答 解:甲醇燃料碱性电池中,加入燃料的电极是负极,所以加入甲醇的电极是负极,充入氧气的电极是正极,负极反应式为CH3OH+8OH--6e-=CO32-+6H2O,正极反应式为3O2+12e-+6H2O=12OH-,
故答案为:正极;CH3OH+8OH--6e-=CO32-+6H2O.
点评 本题考查化学电源新型电池,为高频考点,明确各个电极上发生的反应是解本题关键,难点是电极反应式的书写,注意结合电解质溶液酸碱性书写.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.下列变化中,需加入氧化剂方能实现的是( )
| A. | MnO4-→Mn2+ | B. | NaCl→AgCl | C. | SO32-→SO42- | D. | Cu2+→Cu |
9.在下列各组溶液中,离子一定能大量共存的是( )
| A. | 加入KSCN溶液显红色的溶液:K+、NH4+、Cl-、I- | |
| B. | $\frac{{K}_{W}}{c({H}^{+})}$=0.1 mol•L-1的溶液:Na+、K+、SiO32-、NO3- | |
| C. | FeCl3溶液:K+、Na+、SO42-、AlO2- | |
| D. | 含0.1mol/LNH4Al(SO4)2的溶液:K+、Ca2+、HCO3-、Cl- |
 依据氧化还原反应:Cu+2Fe3+═Cu2++Fe3+设计的原电池如图.请回答下列问题:
依据氧化还原反应:Cu+2Fe3+═Cu2++Fe3+设计的原电池如图.请回答下列问题: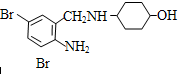 ,不考虑立体异构)是临床上使用广泛的.下图所示的其多条合成路线中的一条(反应试剂和反应条件均未标出)
,不考虑立体异构)是临床上使用广泛的.下图所示的其多条合成路线中的一条(反应试剂和反应条件均未标出)

 .
.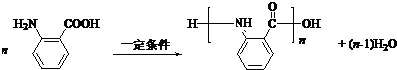 .
. .
.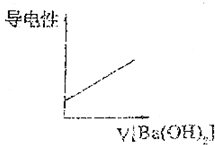

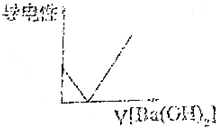
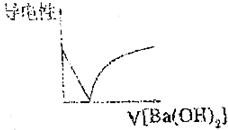
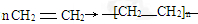 .
.