题目内容
甲醇是一种重要的可再生能源,工业上可用CO和H2合成。
(1)已知:CO(g)+1/2O2(g)=CO2(g) △H=—283 kJ·mol—1
CH3OH(l)+3/2O2(g)=CO2(g) +2H2O(l) △H=—725kJ·mol—1
若要求得CO(g)+2H2(g)=CH3OH(l)的△H,还需要知道反应(用化学方程式表示) 的焓变。
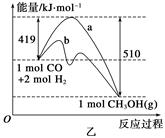
(2)在Cu2O/ZnO做催化剂的条件下,将CO(g)和H2(g)充入容积为2L的密闭容器中合成CH3OH(g),反应过程中,CH3OH的物质的量(n)与时间(t)及温度的关系如图。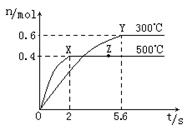
根据题意回答下列问题:
①反应达到平衡时,平衡常数表达式K= ;
升高温度,K值 (填“增大”、“减小”
或“不变”)。
②在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)= 。
③若其它条件不变,对处于Z点的体系,将体积压缩至原来的1/2,达到新的平衡后,下列有关该体系的说法正确的是 。
a.氢气的浓度与原平衡比减少 b.正、逆反应速率都加快
c.甲醇的物质的量增加 d.重新平衡时n(H2) /n(CH3OH)增大
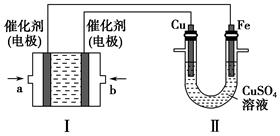
④据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量的CO2有利于维持Cu2O的量不变,原因是: (写出相关的化学方程式并辅以必要的文字说明)。
(1)2H2(g)+O2(g)=2H2O(l)(只要写对反应式即给1分。没配平扣1分,没标明状态扣1分,若二者都存在只扣1分。)
(2)① ; 减小。②0.2mol·L—1·s—1(没有单位或错扣1分)。③bc(各1分。填错一个倒扣1分,不出现负分。)。
; 减小。②0.2mol·L—1·s—1(没有单位或错扣1分)。③bc(各1分。填错一个倒扣1分,不出现负分。)。
④Cu2O+CO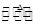 2Cu+CO2,体系中有CO2可以抑制Cu2O被还原。(3分。化学方程式给1分,文字说明給2分。若化学方程式用可逆号,文字说明只要从化学平衡角度回答都给分。若说明CO2与Cu反应生成Cu2O也给分。)
2Cu+CO2,体系中有CO2可以抑制Cu2O被还原。(3分。化学方程式给1分,文字说明給2分。若化学方程式用可逆号,文字说明只要从化学平衡角度回答都给分。若说明CO2与Cu反应生成Cu2O也给分。)
解析试题分析:(1)所求反应中有H2存在,CO2和H2O都是中间产物,结合盖斯定律,可推得还需要的反应为2H2(g)+O2(g)=2H2O(l)的焓变;
(2)①根据反应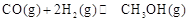 ,其平衡常数表达式
,其平衡常数表达式 ,结合图像,可知升高温度,甲醇含量降低,平衡向逆反应方向移动,说明该反应是放热反应,故升高温度,K值减小;
,结合图像,可知升高温度,甲醇含量降低,平衡向逆反应方向移动,说明该反应是放热反应,故升高温度,K值减小;
②在500℃,从反应开始到平衡,甲醇增加了0.4 mol,H2消耗了0.8 mol,则氢气的平均反应速率v(H2)=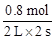 =0.2 mol·L—1·s—1;
=0.2 mol·L—1·s—1;
③Z点处于平衡状态,将体积压缩至原来的1/2,相当于加压了,平衡正向移动,依次进行解答;
a、各物质的浓度均比原来增大了,错误;
b、浓度增大导致正、逆反应速率都加快,正确;
c、因平衡正向移动,甲醇的物质的量增加,正确;
d、因平衡正向移动,氢气减少,甲醇增加,所以n(H2) /n(CH3OH)将减小,错误;
④二氧化碳有利于抑制反应 Cu2O+CO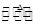 2Cu+CO2向正反应方向移动,维持Cu2O的量不变,。
2Cu+CO2向正反应方向移动,维持Cu2O的量不变,。
考点:考查盖斯定律,化学平衡常数,化学平衡移动影响因素。

 阅读快车系列答案
阅读快车系列答案已知反应①Fe(s)+CO2(g) FeO(s)+CO(g) ΔH="a" kJ·mol-1,平衡常数为K;反应②CO(g)+1/2O2(g)
FeO(s)+CO(g) ΔH="a" kJ·mol-1,平衡常数为K;反应②CO(g)+1/2O2(g) CO2(g) ΔH="b" kJ·mol-1;反应③Fe2O3(s)+3CO(g)
CO2(g) ΔH="b" kJ·mol-1;反应③Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) ΔH="c" kJ·mol-1。测得在不同温度下,K值如下:
2Fe(s)+3CO2(g) ΔH="c" kJ·mol-1。测得在不同温度下,K值如下:
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
(1)若500 ℃时进行反应①,CO2的起始浓度为2 mol·L-1,CO的平衡浓度为 。
(2)反应①为 (选填“吸热”或“放热”)反应。
(3)700 ℃时反应①达到平衡状态,要使该平衡向右移动,其他条件不变时,可以采取的措施有 (填序号)。
A.缩小反应器体积 B.通入CO2 C.温度升高到900 ℃ D.使用合适的催化剂
E.增加Fe的量
(4)下列图像符合反应①的是 (填序号)(图中v为速率,φ为混合物中CO含量,T为温度且T1>T2)。
(5)由反应①和②可求得,反应2Fe(s)+O2(g)
 2FeO(s)的ΔH= 。
2FeO(s)的ΔH= 。 (6)请运用盖斯定律写出Fe(固体)被O2(气体)氧化得到Fe2O3(固体)的热化学方程式: 。
我国工业上主要采用以下四种方法降低尾气中的含硫量:
| 方法1 | 燃煤中加入石灰石,将SO2转化为CaSO3,再氧化为CaSO4 |
| 方法2 | 用氨水将SO2转化为NH4HSO3,再氧化为(NH4)2SO4 |
| 方法3 | 高温下用水煤气将SO2还原为S |
| 方法4 | 用Na2SO3溶液吸收SO2,再电解转化为H2SO4 |
(1)方法1中已知:① CaO(s)+CO2(g)=CaCO3(s) ΔH=-178.3 kJ/mol
②CaO(s)+SO2(g)=CaSO3(s) ΔH=-402.0 kJ/mol
③2CaSO3(s)+O2(g)=2CaSO4(s) ΔH=-2314.8 kJ/mol
写出CaCO3与SO2反应生成CaSO4的热化学方程式:____;此反应的平衡常数表达式为:_____。
(2)方法2中最后产品中含有少量(NH4)2SO3,为测定(NH4)2SO4的含量,分析员设计以下步骤:
①准确称取13.9 g 样品,溶解;
②向溶液中加入植物油形成油膜,用滴管插入液面下加入过量盐酸,充分反应,再加热煮沸;
③加入足量的氯化钡溶液,过滤;
④进行两步实验操作;
⑤称量,得到固体23.3 g,计算。
步骤②的目的是:_____。步骤④两步实验操作的名称分别为: _____、_____。样品中(NH4)2SO4的质量分数:____(保留两位有效数字)。
(3)据研究表明方法3的气配比最适宜为0.75[即煤气(CO、H2的体积分数之和为90%)∶SO2烟气(SO2体积分数不超过15%)流量=30∶40]。用平衡原理解释保持气配比为0.75的目的是:_____。
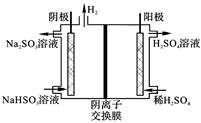
(4)方法4中用惰性电极电解溶液的装置如图所示。阳极电极反应方程式为_____。
 CH3OH(g) ΔH
CH3OH(g) ΔH
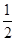 O2(g)===H2O(l) ΔH3=-285.84 kJ·mol-1
O2(g)===H2O(l) ΔH3=-285.84 kJ·mol-1 CH3OH(g) △H 1=-90.7 kJ·mol-1
CH3OH(g) △H 1=-90.7 kJ·mol-1
 CH3OH(g)。工业上依此用CO生产燃料甲醇。
CH3OH(g)。工业上依此用CO生产燃料甲醇。
 增大的有____________。
增大的有____________。