题目内容
氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3-+4H++3e-=NO↑+2H2O。KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出该氧化还原反应的化学方程式:________。
(2)反应中硝酸体现了________、________。
(3)反应中若产生标准状况下11.2L气体,则转移电子的物质的量是________ mol。
(4)现称取含有杂质的甲样品(杂质与酸不反应)5.4 g,恰好与100 mL 1.4 mol·L-1的硝酸溶液完全反应,则该样品的纯度为________。
(5)若1 mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是________。
(1)14HNO3+3Cu2O=6Cu(NO3)2+2NO↑+7H2O
(2)酸性;氧化性
(3)1.5
(4)80%
(5)使用了较浓的硝酸,产物中有NO2生成
【解析】(1)由于NO3-+4H++3e-=NO↑+2H2O是还原过程,需要加入还原剂才能发生,而KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中具有较强还原性的只有Cu2O,Cu2O被氧化生成Cu2+,化学方程式为:14HNO3+3Cu2O=6Cu(NO3)2+2NO↑+7H2O;(2)硝酸在反应中体现了酸性和氧化性;(3)依据反应式:NO3-+4H++3e-=NO↑+2H2O,若产生标准状况下 =0.5 mol气体,则转移电子的物质的量是0.5 mol×3=1.5 mol;(4)设5.4 g样品中含甲的物质的量为x,由化学方程式可得:
=0.5 mol气体,则转移电子的物质的量是0.5 mol×3=1.5 mol;(4)设5.4 g样品中含甲的物质的量为x,由化学方程式可得: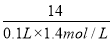 =
= ,解得x=0.03 mol,则样品中甲的质量分数为
,解得x=0.03 mol,则样品中甲的质量分数为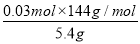 ×100%=80%;(5)若1 mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,则硝酸的还原产物的价态应比NO中氮元素的价态高,依据浓硝酸反应的规律知,应是使用了较浓的硝酸,产物中有NO2生成。
×100%=80%;(5)若1 mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,则硝酸的还原产物的价态应比NO中氮元素的价态高,依据浓硝酸反应的规律知,应是使用了较浓的硝酸,产物中有NO2生成。