题目内容
3.某溶液中可能含有:Na+、Mg2+、Fe2+、Fe3+、I-、Cl-、NO3-、CO32-、SO42-中的几种(不考虑水的电离和离子的水解因素),各离子浓度均0.1mol•L-1.往该溶液中加入过量稀盐酸,溶液颜色变深且阴离子种类不变,下列说法不正确的是( )| A. | 溶液颜色变深可能是Fe2+或I-被氧化 | |
| B. | 原溶液中肯定含有Fe2+、Cl-、NO3-,肯定不含有Na+、Fe3+、I-、CO32- | |
| C. | 取少量原溶液,加入盐酸酸化的BaCl2溶液,若有白色沉淀产生,则原溶液中含有Mg2+ | |
| D. | 该溶液中是否存在Na+,无需通过焰色反应确定 |
分析 往该溶液中加入过量稀盐酸,溶液颜色变深且阴离子种类不变,只能是亚铁离子被氧化为铁离子,不会是碘离子被氧化为单质碘,所以溶液中一定有Fe2+、Cl-、NO3-,则一定没有I-,亚铁离子与碳酸根离子水解相互促进导致水解完全而不能共存,所以没有碳酸根离子;各离子浓度均0.1mol•L-1,若只有Fe2+、Cl-、NO3-,溶液为电中性,可能还有镁离子和硫酸根离子,溶液仍为电中性,不会有Na+和Fe3+,否则溶液不会是电中性,据此分析.
解答 解:A、溶液中一定没有碘离子,故A错误;
B、往该溶液中加入过量稀盐酸,溶液颜色变深且阴离子种类不变,只能是亚铁离子被氧化为铁离子,不会是碘离子被氧化为单质碘,所以溶液中一定有Fe2+、Cl-、NO3-,则一定没有I-,亚铁离子与碳酸根离子水解相互促进导致水解完全而不能共存,所以没有碳酸根离子;各离子浓度均0.1mol•L-1,若只有Fe2+、Cl-、NO3-,溶液为电中性,可能还有镁离子和硫酸根离子,溶液仍为电中性,不会有Na+和Fe3+,否则溶液不会是电中性,故B正确;
C、加入盐酸酸化的BaCl2溶液,若有白色沉淀产生,说明溶液中含有硫酸根离子,则有镁离子,故C正确;
D、溶液中没有钠离子,故C正确;
故选A.
点评 本题考查了常见阴阳离子的检验、离子共存的判断,题目难度中等,根据离子共存及电中性知识正确判断阴阳离子可能组成为解答关键,试题侧重考查学生的分析能力及逻辑推理能力.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
13.盐酸克伦特罗(俗称“瘦肉精”),其结构简式如图,有关瘦肉精的说法的是( )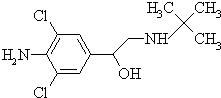

| A. | 属于芳香烃 | |
| B. | 化学式为:C12H17ON3C12 | |
| C. | 遇FeCl3溶液发生显色反应 | |
| D. | 可在一定条件下发生取代,加成,酯化,消去反应 |
14.实验室准备较快地制取氢气,可采用的方法是( )
| A. | 用纯锌与稀硫酸反应 | |
| B. | 用粗锌与稀硫酸反应 | |
| C. | 用粗锌与稀硝酸反应 | |
| D. | 在CuSO4溶液中浸泡过的纯锌与稀硫酸反应 |
11.乙烯一种化工原料,某实验小组利用如下装置制备.发生的反应如下:CH3-CH2-OH$\stackrel{P_{2}O_{5}}{→}$CH2=CH↑+H2O
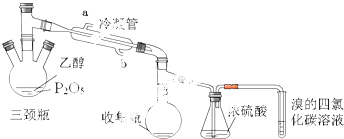
在三颈瓶中加入一定量P2O5,并注入10.0g 92%的乙醇,采用两种加热方式进行两次实验,观察现象.
回答下列问题:
(1)如图图装置中冷凝管的作用是冷凝导气,出水口为(填“a”或“b”)a,
(2)若实验中采用70℃水浴加热方式,还需要仪器有大烧杯、温度计(加热、夹持仪器、石棉网除外).
(3)浓硫酸的作用是除去乙烯中的水蒸气,三颈瓶、收集瓶中的液体经检验为磷酸三乙酯,写出三颈瓶中生成磷酸的化学方程式P2O5+3H2O=2H3PO4.
(4)已知进行两次实验,实验现象:实验1 中溴的四氯化碳溶液褪色,实验2 中溴的四氯化碳溶液不褪色.实验1使溴的四氯化碳溶液褪色的物质是乙烯,可以推断:以P2O5作为催化剂获得乙烯的反应条件是较高温度下或直接加热
(5)实验1中,溴的四氯化碳溶液增重4.48g,乙烯的产率为80%.

在三颈瓶中加入一定量P2O5,并注入10.0g 92%的乙醇,采用两种加热方式进行两次实验,观察现象.
| 实验 | P2O5/g | 92%乙醇量/mL | 加热方式 |
| 实验1 | 2 | 4 | 酒精灯 |
| 实验2 | 2 | 4 | 水浴70℃ |
(1)如图图装置中冷凝管的作用是冷凝导气,出水口为(填“a”或“b”)a,
(2)若实验中采用70℃水浴加热方式,还需要仪器有大烧杯、温度计(加热、夹持仪器、石棉网除外).
(3)浓硫酸的作用是除去乙烯中的水蒸气,三颈瓶、收集瓶中的液体经检验为磷酸三乙酯,写出三颈瓶中生成磷酸的化学方程式P2O5+3H2O=2H3PO4.
(4)已知进行两次实验,实验现象:实验1 中溴的四氯化碳溶液褪色,实验2 中溴的四氯化碳溶液不褪色.实验1使溴的四氯化碳溶液褪色的物质是乙烯,可以推断:以P2O5作为催化剂获得乙烯的反应条件是较高温度下或直接加热
(5)实验1中,溴的四氯化碳溶液增重4.48g,乙烯的产率为80%.
8.下列离子方程式中不正确的是( )
| A. | 工业上制取Cl2:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$ 2OH-+Cl2↑+H2↑ | |
| B. | 碘化钾溶液跟适量溴水反应:2I-+Br2=I2+2Br- | |
| C. | 将金属钠加入水中:Na+2H2O=Na++2OH-+H2↑ | |
| D. | 将氯气通入氯化亚铁溶液中:2Fe2++Cl2=2Fe3++2Cl- |
15.下列各组物质中,不是同分异构体的是( )
| A. | 正丁烷、2-甲基丙烷 | B. | 乙酸、甲酸甲酯 | ||
| C. | 淀粉、纤维素 | D. | 乙醇、二甲醚 |
12.取1mol有机物甲(分子结构如图),与足量的溴水或NaOH溶液反应,最多消耗的Br2与NaOH分别是( )
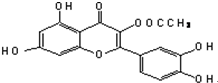

| A. | 5mol、5mol | B. | 5mol、6mol | C. | 6mol、5mol | D. | 6mol、6mol |
13.下列物质属于同系物的是( )
| A. | CH2=CH2和CH2=CHCH=CH2 | B. | CH3CH2Cl和CH2ClCH2CH2Cl | ||
| C. | C2H5OH和CH4O | D. | CH3COOH和C17H33COOH |