题目内容
摩尔盐[xFeSO4·y(NH4)2SO4·zH2O]是一种重要化工原料。其组成可通过下列实验测定:
①称取1.5680 g样品,准确配成100 mL溶液A。
②量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤,干燥至恒重,得到白色固体0.4660 g。
③再量取25.00 mL溶液A,滴加适量稀硫酸,用0.0200 mol·L-1KMnO4溶液滴定至终点,生成Mn2+,消耗KMnO4溶液10.00 mL。
(1)已知室温下BaSO4的Ksp=1.1×10-10,欲使溶液中c(SO42-)≤1. 0×10-5mol·L-1,应保持溶液中c(Ba2+)
≥ mol·L-1。
(2)③中发生反应的离子方程式为 ,滴定终点的现象是 。
(3)通过计算确定样品的组成(必须写出计算过程)。
(1)1.1×10-5 (2分)
(2)MnO4-+5 Fe2++8H+=Mn2++5 Fe3++4H2O(2分)
溶液由无色变为浅紫色(紫色、紫红色),且半分钟不褪色 (1分)
(3)n(SO42-)= n(BaSO4)=0. 466g/233g·mol-1=2. 00×10-3 mol (或2.00mmol) (2分)
n(Fe2+)=5×0. 02000 mol·L-1×10. 00 mL/1000 mL·L-1=1. 000×10-3mol (1分)
n(NH4+)=2×2. 00×10-3 mol-2×1. 000×10-3mol=2. 000×10-3mol (1分)
n(H2O)=(1.5680 g×25.00 mL/100.00mL-1.000×10-3mol
×152g·mol-1-1.000×10-3mol×132g·mol-1)/18 g·mol-1
=6. 000×10-3mol (2分)
x∶y∶z=n(FeSO4)∶n[ (NH4)2SO4]∶n(H2O)=1∶1∶6
该摩尔盐的化学式为FeSO4·(NH4)2SO4·6H2O (1分)
解析试题分析:本题是测定物质组成的计算题。
(1)Ksp= c(Ba2+) × c(SO42-)=1.1×10-10 c(Ba2+)= 1.1×10-5 mol·L-1
(3)在步骤②中得到的白色固体为BaSO4,由此计算出SO42-的含量;在步骤③中根据反应方程式计算出溶液中含有的Fe2+的含量,再根据电荷守恒计算出溶液中含有NH4+的含量。但要注意所取的溶液只是原溶液的1/5,计算原溶液中SO42-和Fe2+的物质的量。最后根据总质量计算水的含量,确定组成。
考点:考查工业测定物质组成中的有关实验操作、计算等内容。

结合下表回答下列问题(均为常温下的数据):
| 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
| CH3COOH | 1.8×10-5 | H2CO3 | K1=4.4×10-7 K2=4.7×10-11 |
| HClO | 3×10-8 |
(1)上述三种酸中,酸性最强的是 。
(2)在常温下,相同物质的量浓度的①CH3COONa、 ②Na2CO3、③NaClO三种溶液的pH由小到大的顺序为 。(用序号回答)
(3)设计一个现象明显、操作简便的实验方案证明CH3COOH酸性强于碳酸(不用叙述仪器和具体操作) 。
(4)向Na2CO3溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的钠盐,同时还有另两种钠盐生成,该反应的化学方程式为 。
(5)实验证明:向0.01 mol/L NaAlO2溶液中加入等体积0.01 mol/L NaHCO3溶液,会产生白色胶状沉淀。据此推断CO32-和AlO2-两种离子中,结合质子(H+)能力较强的是 。
(1)已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10—1 | 1.8×10—5 | 4.9×10—10 | K1=4.3×10—7 K2=5.6×10—11 |
①等物质的量浓度的a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的pH由大到小的顺序为
(填序号)。
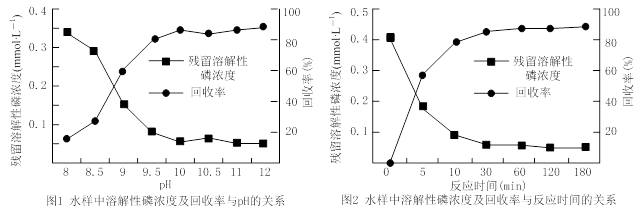
②25℃时,将20 mL 0.1 mol·L—1 CH3COOH溶液和20 mL 0.1 mol·L—1HSCN溶液分别与20 mL 0.1 mol·L—1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是 。反应结束后所得两溶液中,c(CH3COO—) c(SCN—)(填“>”、“<”或“=”)

③若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是______(填序号)。
a. c(CH3COO-) b. c(H+) c. Kw d. 醋酸电离平衡常数
(2)下图为某温度下,PbS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2—浓度、金属阳离子浓度变化情况。如果向三种沉淀中加盐酸,最先溶解的是 (填化学式)。向新生成的ZnS浊液中滴入足量含相同浓度的Pb2+、Fe2+的溶液,振荡后,ZnS沉淀会转化为 (填化学式)沉淀。

(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解50 mL 2 mol·L—1的氯化铜溶液的装置示意图:

请回答:
① 甲烷燃料电池的负极反应式是 。
② 当线路中有0.1 mol电子通过时, 极增重________g
某化学实验小组想要了解市场所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定。
(1)该实验应选用 作指示剂,量取一定体积的白醋所用的仪器是 。
(2)如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为 mL。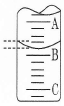
(3)为了减小实验误差,该同学一共进行了3次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为cmo1/L,3次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是( )
A.初读正确,实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管装液前用蒸馏水洗净,未用标准液润洗
D.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)白醋溶液中存在的电离平衡为 (用电离平衡方程式表示)。
(5)在滴定过程中,当c(CH3COOˉ)>c(Na+)时,则混合溶液呈____(填序号)。
A.酸性 B.碱性 C.中性 D.无法确定
(6)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):c= 。