题目内容
8.下列推断正确的是 ( )| A. | 0.25g磷与氯气反应,消耗氯气314mL(折换成标况下),生成的三氯化磷和五氯化磷的物质的量的比约为2:1 | |
| B. | 氨气在纯氧气中燃烧:4NH3+5O2═4NO+6H2O | |
| C. | 因为二氧化氮和一氧化碳的密度都比空气大,所以都可以用向上排空气法收集 | |
| D. | 因为SO2、P2O5和CO2都是酸性氧化物,所以能与氢氧化钠溶液反应生成盐和水 |
分析 A.根据n=$\frac{m}{M}$计算磷的物质的量,根据n=$\frac{V}{Vm}$计算氯气的物质的量,进而计算产物中n(Cl):n(P)的值,据此利用十字交叉法计算产物中PCl3与PCl5的物质的量之比;
B.燃烧生成NO和水,遵循电子、原子守恒,反应条件为点燃;
C.CO不能利用排空气法收集;
D.酸性氧化物与碱反应生成盐和水.
解答 解:A.参加反应的P和Cl2的物质的量之比为$\frac{0.25g}{31g/mol}$:$\frac{0.314L}{22.4L/mol}$≈1:1.74,因此产物中n(Cl):n(P)=(1.74×2):1=3.48:1,
则: ,即产物中PCl3和PCl5的物质的量之比1.52:0.48≈3:1,故A错误;
,即产物中PCl3和PCl5的物质的量之比1.52:0.48≈3:1,故A错误;
B.氨气在纯氧气中燃烧的反应为4NH3+5O2$\frac{\underline{\;点燃\;}}{\;}$4NO+6H2O,故B错误;
C.二氧化氮和一氧化碳的密度都比空气大,二氧化氮可以用向上排空气法收集,CO不能,故C错误;
D.SO2、P2O5和CO2都是酸性氧化无,均能与氢氧化钠溶液反应生成盐和水,故D正确;
故选D.
点评 本题考查物质的性质,为高频考点,把握物质的性质、发生的反应及气体的收集方法、酸性氧化物判断等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案
相关题目
2.下列有关能量变化的说法中正确的是( )
| A. | 加热或高温下发生的反应是吸热反应 | |
| B. | 放热反应是自发的,吸热反应不是自发的 | |
| C. | 醋酸钠的水解△H<0,醋酸的电离△H>0 | |
| D. | 化学反应中的能量变化源于化学键的断裂和形成 |
20.在中学化学实验中,对某些化学试剂进行循环使用,可以节省资源、减少污染、降低成本.下列做法不合理的是 ( )
| 选项 | 实验名称 | 回收试剂 | 回收方法 | 回收后用途 |
| A | 加热KClO3与MnO2制氧气 | 二氧化锰 | 溶解、过滤、洗涤、干燥 | 重复使用 |
| B | 过氧化钠与水反应 | 氯化钠 | 加入过量盐酸、蒸发、结晶 | 制取实验备用 |
| C | 用CCl4萃取溴水中的溴 | 四氯化碳 | 碱液洗涤、分液 | 重复使用 |
| D | 浓硫酸的稀释 | 稀硫酸 | 直接密封保存 | 制氢气、硫酸盐等 |
| A. | A | B. | B | C. | C | D. | D |
3.化学是人类用以认识和改造物质世界的主要方法和手段之一,A、B、C、D、X、Y是中学化学 常见的物质,现在欲用A制取D.路径是A与X反应生成B,B与X反应生成C,C与Y反应生成D.下列判断不正确的是 ( )
| A. | 假设D是纯碱,则A可以是单质 | |
| B. | 假设D是碱,则A、B、C均可与Y反应生成D | |
| C. | 假设D是碱,则A可以是单质,A也可以是化合物,且X可以是水 | |
| D. | 假设D是酸,则A可以是单质,A也可以是化合物,且D与还原剂反应可生成B或C |
13.下列说法或判断正确的是( )
| A. | 二氧化硅是光纤制品及现代光学的基本原料 | |
| B. | 塑化剂是一种化工塑料软化剂,可以大量添加到婴幼儿玩具中 | |
| C. | 二氧化硅不与任何酸反应,可以用石英做材料制造耐酸容器 | |
| D. | 氢氧化铁溶胶、甘油与乙醇的混合液、含PM2.5的大气均具有丁达尔效应 |
20.下列制备和收集气体的实验装置合理的是( )
| A. |  用氯化铵和氢氧化钙制NH 3 | B. | 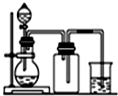 用铜片和稀硝酸制NO | ||
| C. | 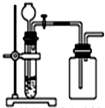 用锌粒和稀硫酸制H 2 | D. | 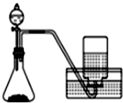 用双氧水和二氧化锰制O2 |
17.如表中关于物质分类的正确组合是( )
| 类别组合 | 酸性氧化物 | 碱性氧化物 | 酸 | 碱 | 盐 |
| A | NO2 | CuO | H2SO4 | NH3•H2O | Na2S |
| B | CO2 | Na2O | CH3COOH | NaOH | NaHCO3 |
| C | SO2 | Al2O3 | HCl | KOH | NaCl |
| D | SO3 | CaO | HNO3 | Na2CO3 | CaCO3 |
| A. | A | B. | B | C. | C | D. | D |