题目内容
1.(1)用双线桥法配平,并标出电子转移方向与数目:3Cu+8HNO3 (稀)═3Cu(NO3)2+2NO↑+4H2O
(2)在标准状况下生成1.12L气体时,反应中转移的电子数为0.15NA,参加反应的氧化剂与还原剂物质的量之比为2:3.
分析 (1)该反应中Cu元素化合价由0价变为+2价、N元素化合价由+5价变为+2价,根据转移电子相等、原子守恒配平方程式;
(2)根据氧化剂和还原剂之间的关系式、生成的气体NO和转移电子之间的关系式计算.
解答 解:(1)该反应中Cu元素化合价由0价变为+2价、部分N元素化合价由+5价变为+2价,其得失电子最小公倍数是6,
用双线桥标出该反应电子转移的方向和数目为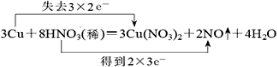 ,
,
故答案为:3;8;3;2;4; ;
;
(2)该反应中有$\frac{1}{4}$的硝酸作氧化剂,则氧化剂和还原剂的物质的量之比为2:3,如果生成1.12L即0.05mol气体时,反应中转移的电子数为0.05×3=0.15mol,转移电子数=0.15mol×NA/mol=0.15NA,故答案为:0.15NA;2:3.
点评 本题以硝酸和铜反应为载体考查了氧化还原反应,根据元素化合价变化确定硝酸的性质,再结合各个物理量之间的关系式计算,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.以NA表示阿佛加德罗常数的值,下列说法中正确的是( )
| A. | 含53g碳酸钠的水溶液中含NA个CO32- | |
| B. | 0.1molOH-含NA个电子 | |
| C. | 1.8g重水(D2O)中含NA个中子 | |
| D. | 一定条件下的密闭容器中,足量N2与3mol H2充分反应可生成NH3 2NA |
9.下列反应属于放热反应的是( )
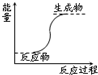

| A. | 氢氧化钡晶体和氯化铵晶体的反应 | B. | 能量变化如右图所示的反应 | ||
| C. | 不需要加热就能够发生的反应 | D. | 铁与盐酸的反应 |
6.位于元素周期表第二周期ⅥA族的元素是( )
| A. | Li | B. | O | C. | Al | D. | Cl |
13.下列四种盐酸溶液,均能跟锌片反应,其中最初反应速率最快的是( )
| A. | 10℃20mL 0.3mol•L-1的盐酸溶液 | B. | 20℃30mL 0.2mol•L-1的盐酸溶液 | ||
| C. | 20℃20mL 0.2 mol•L-1的盐酸溶液 | D. | 20℃30mL 0.4 mol•L-1的盐酸溶液 |
10.1999年美国《科学》杂志报道:在40GPa高压下,用激光器加热到1800K,人们成功制得了原子晶体干冰,下列推断正确的是( )
| A. | 原子晶体干冰的熔点、沸点与干冰的相同 | |
| B. | 原子晶体干冰结构与二氧化硅结构不同 | |
| C. | 原子晶体干冰硬度大,可用作耐磨材料 | |
| D. | 每摩尔原子晶体干冰中含4mol氧原子 |
11.下列实验现象与氧化还原反应无关的是( )
| A. | 氯气使品红溶液褪色 | |
| B. | NO2 通入水中,气体由红棕色逐渐转变为无色 | |
| C. | 将铁片放入CuSO4溶液中,铁片表面有红色物质出现 | |
| D. | 向硅酸钠溶液中滴加适量的稀盐酸,有透明的凝胶形成 |
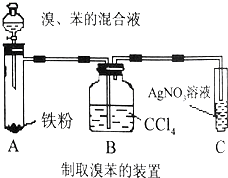 苯是一种重要的有机化工原料,广泛用于合成工业产品.回答下列问题:
苯是一种重要的有机化工原料,广泛用于合成工业产品.回答下列问题: