题目内容
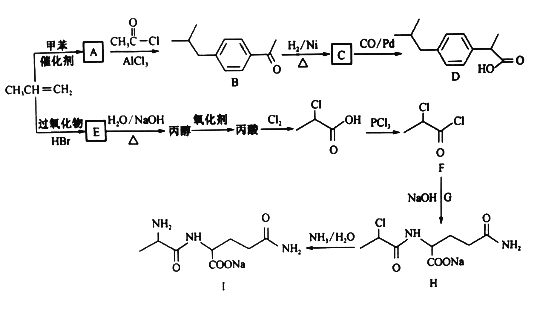
【题目】锂--磷酸氧铜电池正极的的活性物质是Cu4O(PO4)2,可通过下列反应制备:2Na3PO4+CuSO4+2NH3·H2O= Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O。
(1)写出基态Cu2+的电子排布式:_______________。
(2)PO43-的空间构型是___________________。
(3)P、S元素第一电离能大小关系为_____________________。
(4)氨基乙酸铜分子结构如图,碳原子的杂化方式为_____________,基态碳原子核外电子有__________个空间运动状态。

(5)铜晶体密堆积方式如图所示,铜原子的配位数为___________,铜的原子半径为127.8pm,NA表示阿伏加德罗常数的值,列出晶体铜的密度计算式_________g·cm-3。

【答案】 3d9 正四面体 P>S sp3 sp2 6 12 ![]()
【解析】(1)铜的原子序数是29,则基态Cu2+的电子排布式为3d9。(2)PO43-中P原子的价层电子对=4+(5+3-4×2)/2=4,且不含孤电子对,所以其空间构型正四面体。(3)P的3p轨道电子处于半充满状态,稳定性强,能量较低,则P、S元素第一电离能大小关系为P>S;(4)氨基乙酸铜的分子中一种碳有碳氧双键,C原子含有3个σ键,碳的杂化方式为sp2杂化,另一种碳周围都是单键,C原子含有4个σ键,碳的杂化方式为sp3杂化;C原子具有6个核外电子,处于不同能层、能级上的电子具有的能量不同,同一能级上的电子自旋方向相反,故有6种不同的运动状态。(5)根据图可知,Cu的晶胞为面心立方最密堆积,以顶点Cu原子研究,与之最近的Cu原子位于面心上,每个顶点Cu原子为12个面共用,所以Cu的配位数为12;铜晶体为面心立方最密堆积,则每个晶胞中含有铜的原子:8×1/8+6×1/2=4,Cu原子半径为r=127.8pm=1.278×10-8cm,设晶胞的边长为d,则有![]() ,所以d=
,所以d= ![]() ,所以晶体铜的密度为:
,所以晶体铜的密度为:  。
。