题目内容
【题目】宏观物质的性质是由微观结构决定的。
(1)1998年,美国科学家合成了一种阳离子“NSn+”,其结构是对称的,5个N排成“V”形,如果5个N结合后都达到8电子结构,且含有2个N≡N。则n=__________,NSn+的电子式为______________________________。
(2)科学家们还获得了一种Na分子,分子中所有N原子均呈单键,且均满足8电子结构,试画出该分子的结构式__________________________。
(3)科学家们认为存在含氢量最高的化合物NH6,预测其与水剧烈反应入出气体,所得水溶液呈弱碱性。写出该反应的化学方程式__________,NH6的电子式为____________________。
【答案】 1 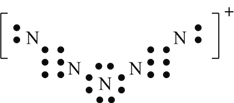
 NH5+H2O=H2↑+NH3·H2O
NH5+H2O=H2↑+NH3·H2O 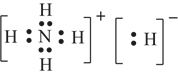 。
。
【解析】(1)由5个N结合,都达到8电子结构,且含有两个N≡N三键,故N≡N只能在链端,其结构为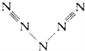 ,两个N-N为配位键,电子对由靠近三键的N提供,故中间的N原子需失去一个电子达到稳定结构,所以N5分子碎片所带电荷是+1;由其结构式写出电子式为:
,两个N-N为配位键,电子对由靠近三键的N提供,故中间的N原子需失去一个电子达到稳定结构,所以N5分子碎片所带电荷是+1;由其结构式写出电子式为: ;
;
(2)Na分子中所有N原子均呈单键,且均满足8电子结构,可知一个N原子与其它三个N原子形成三个N—N键,则该分子为正方体结构,其结构式为 ;
;
(3)NH6与水剧烈反应放出气体,所得水溶液呈弱碱性,说明所得溶液为氨水,生成的气体为氢气。根据电子守恒可知该反应的化学方程式为NH5+H2O=H2↑+NH3·H2O,NH6含有NH4+和H-,为离子形化合物,其电子式为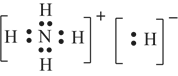 。
。

练习册系列答案
相关题目