��Ŀ����
����Ŀ���״���һ�ֿ�������Դ�����п�����Ӧ�õĹ���ǰ������ش��������⣺
��1��һ���¶��£���һ���ݵ��ܱ������У���CO��H2�ϳɼ״���CO��g��+2H2��g�� ![]() CH3OH��g��
CH3OH��g��
������������˵���÷�Ӧ�Ѵﵽƽ��״̬����___________������ţ�
A��ÿ����1mol CO��ͬʱ����2molH2
B��������������ʵ�������
C������CH3OH������������CO���������
D��CH3OH��CO��H2��Ũ�ȶ����ٷ����仯
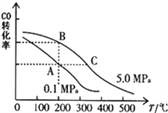
��CO��ƽ��ת���ʣ��������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��ʾ��B��C�����ƽ�ⳣ��K��C��____K��B����������������=������������
��ij�¶��£���2.0mol CO��6.0molH2����2L���ܱ������У��ﵽƽ��ʱ���c��CO��=0.25mol/L��CO��ת����=______�����¶��µ�ƽ�ⳣ��K=______��������λ��Ч���֣�
��2�������£���V mL��0.20mol/L����������Һ��μ��뵽20.00mL��0.20mol/L������Һ�У���ַ�Ӧ����ҺpH=7����ʱV______20.00��������������=��������������������������Һ�������Һǡ����ȫ��Ӧʱ����Һ����������Ũ���ɴ�С����˳��______________________
��3���¶�650����������ȼ�ϵ�أ��ã�CO��H2������Ӧ�������CO2�Ļ������Ϊ������Ӧ������缫����Li2CO3��Na2CO3�����������ʡ��õ�ص�������Ӧʽ______________________________��
���𰸡� ABD �� 75% 1.3 �� c(Na+)>c(HCOO-)>c(OH-)>c(H+) O2+4e��+2CO2 = 2CO32��
�����������������(1) �����ݻ�ѧƽ��״̬���������桢���������䡢�����ش��жϣ�C����¶ȴ���B�㣬�����¶�CO��ƽ��ת���ʼ�С��ƽ�������ƶ�����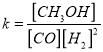 ,����������ʽ������ƽ�ⳣ������2�����������ᣬ����������ǿ�����ǡ����ȫ��Ӧʱ���ɴ����ƣ�������ˮ����Һ�ʼ�������3�������������õ�������̼������ӣ�
,����������ʽ������ƽ�ⳣ������2�����������ᣬ����������ǿ�����ǡ����ȫ��Ӧʱ���ɴ����ƣ�������ˮ����Һ�ʼ�������3�������������õ�������̼������ӣ�
������(1) ��A��ÿ����1mol CO��ͬʱ����2molH2����֤�����淴Ӧ������ȣ����Է�Ӧһ���ﵽƽ��״̬����A��ȷ��B���÷�Ӧ���������ʵ�����С�ķ�Ӧ��������������ʵ���������˵��һ���ﵽƽ��״̬����B��ȷ��C������CH3OH������������CO��������ȣ�����ָ����Ӧ���ʣ����Բ�һ��ƽ�⣬��C����D�����ݻ�ѧƽ��Ķ���CH3OH��CO��H2��Ũ�ȶ����ٷ����仯��һ���ﵽƽ��״̬����D��ȷ����C����¶ȴ���B�㣬�����¶�CO��ƽ��ת���ʼ�С��ƽ�������ƶ�������K��C��<K��B����
��
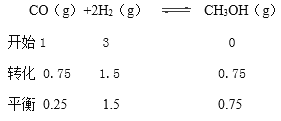
CO��ת����=![]()
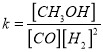 =
=![]() 1.3 ��
1.3 ��
��2�����������ᣬ����������ǿ�����ǡ����ȫ��Ӧʱ���ɴ����ƣ�������ˮ����Һ�ʼ�����Ҫʹ��Һ�����ԣ�Ӧ��С�������Ƶ���������������������Һ�����V<20.00�������ˮ�⣬��Һ�ʼ��ԣ�������Һ����������Ũ���ɴ�С����˳��c(Na+)>c(HCOO-)>c(OH-)>c(H+)��
��3�������������õ�������̼������ӣ��缫��Ӧ��O2+4e��+2CO2 = 2CO32����

����Ŀ��һ�������£��������·�Ӧ�� A(s)+B(g)![]() C(s)+D(g)+E(g) ��H<0��������Է�������M(C)>M(A)����ʼʱͨ��һ������A ��B���÷�Ӧ�ں��ݵ��ܱ������дﵽƽ��������ı�ͼ�к�����x��ֵ�����´ﵽƽ���������yY��X �仯���ƺ�������
C(s)+D(g)+E(g) ��H<0��������Է�������M(C)>M(A)����ʼʱͨ��һ������A ��B���÷�Ӧ�ں��ݵ��ܱ������дﵽƽ��������ı�ͼ�к�����x��ֵ�����´ﵽƽ���������yY��X �仯���ƺ�������
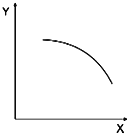
ѡ�� | X | Y |
A | A������ | D��������� |
B | B�����ʵ��� | B��ת���� |
C | B��Ũ�� | ƽ�ⳣ��K |
D | �¶� | �����ڻ�������ƽ��Ħ������ |
A. A B. B C. C D. D