题目内容
(1)等物质的量的SO2与SO3二者的质量之比为
(2)在标准状况下,CO和CO2混合气体的质量为36g,体积为
4:5
4:5
,所含氧原子数之比为2:3
2:3
.(2)在标准状况下,CO和CO2混合气体的质量为36g,体积为
22.4L
22.4L
,则其中CO2所占的体积为 11.2L,CO所占的质量为14g
14g
.分析:(1)结合m=nM及分子的构成计算;
(2)标准状况下,CO和CO2混合气体的质量为36g,CO2所占的体积为 11.2L,其物质的量为
=0.5mol,利用质量关系计算.
(2)标准状况下,CO和CO2混合气体的质量为36g,CO2所占的体积为 11.2L,其物质的量为
| 11.2L |
| 22.4L/mol |
解答:解:(1)设物质的量均为n,等物质的量的SO2与SO3二者的质量之比为n×64g/mol:n×80g/mol=4:5,氧原子个数之比等于物质的量之比,为n×2:n×3=2:3,
故答案为:4:5;2:3;
(2)标准状况下,CO和CO2混合气体的质量为36g,CO2所占的体积为 11.2L,其物质的量为
=0.5mol,
则设CO为xmol,所以x×28g/mol+0.5mol×44g/mol=36g,解得x=0.5mol,
即混合气体为0.5mol+0.5mol-1mol,标况下的体积为1mol×22.4L/mol=22.4L,
CO的质量为0.5mol×28g/mol=14g,
故答案为:2.24L;14g.
故答案为:4:5;2:3;
(2)标准状况下,CO和CO2混合气体的质量为36g,CO2所占的体积为 11.2L,其物质的量为
| 11.2L |
| 22.4L/mol |
则设CO为xmol,所以x×28g/mol+0.5mol×44g/mol=36g,解得x=0.5mol,
即混合气体为0.5mol+0.5mol-1mol,标况下的体积为1mol×22.4L/mol=22.4L,
CO的质量为0.5mol×28g/mol=14g,
故答案为:2.24L;14g.
点评:本题考查物质的量的有关计算,把握物质的量与质量、体积的关系为解答的关键,侧重基本公式和计算能力的考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目

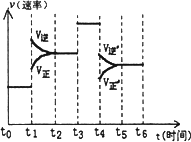
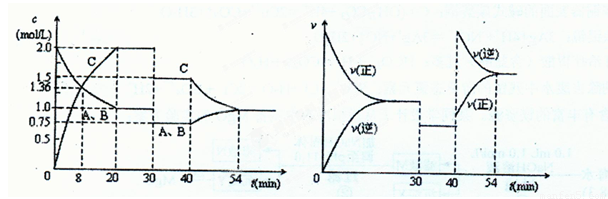
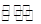 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。下列说法中正确是 (
)
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。下列说法中正确是 (
)