题目内容
【题目】某可逆反应从0~2分钟进行过程中,在不同反应时间各物质的量的变化情况如下图所示。
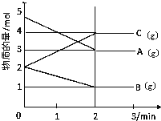
(1)则该反应的化学方程式为__________________;
(2)反应开始至2分钟时,能否用C表示反应速率?_____(填能或不能)。若能,其反应速率为 ;若不能,则其原因为__________;
(3)2分钟后A、B、C各物质的量不再随时间的变化而变化,则此时v正(B)与v逆(C)的等量关系是______________。
【答案】2A+B![]() 2C不能无体积,无法求出浓度变化值2v正(B)=v逆(C)
2C不能无体积,无法求出浓度变化值2v正(B)=v逆(C)
【解析】
(1)根据图示可知在反应中A、B的物质的量减少,C的物质的量增加。所以A、B是反应物,C是生成物。2min时反应达到平衡,此时消耗A和B分别是2mol、1mol,C增加2mol,所以它们反应时的物质的量的之比为2:1:2,因此反应的化学反应方程式是2A+B![]() 2C;
2C;
(2)反应开始至2分钟时,由于只知道物质的量的变化,而不知道容器的容积,所以不能用C表示反应速率。
(3)2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了平衡状态,则根据反应速率之比是相应的化学计量数之比可知此时v正(B)与v逆(C)的等量关系是2v正(B)=v逆(C)。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目