题目内容
(14分)黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量脉石SiO2),为了测定该黄铜矿的纯度,某同学设计了如下实验:


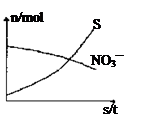
现称取研细的黄铜矿样品1.150 g,在空气存在下进行煅烧,生成Cu、Fe2O3、FeO和SO2气体,实验后取d中溶液的1/10置于锥形瓶中,用0.05000 mol·L-1标准碘溶液进行滴定,初读数为0.10 mL,末读数如右图所示。
(1)冶炼铜的反应为8CuFeS2+ 21O2 高温8Cu + 4FeO + 2Fe2O3+ 16SO2,若CuFeS2中Fe的化合价为+2,反应中被还原的元素是 (填元素符号)。
(2)装置a的作用是 。
(3)上述反应结束后,仍需通一段时间的空气,其目的是 。
(4)滴定时,标准碘溶液所耗体积为 mL。用化学方程式表示滴定的原理: 。
(5)通过计算可知,该黄铜矿的纯度为 。


现称取研细的黄铜矿样品1.150 g,在空气存在下进行煅烧,生成Cu、Fe2O3、FeO和SO2气体,实验后取d中溶液的1/10置于锥形瓶中,用0.05000 mol·L-1标准碘溶液进行滴定,初读数为0.10 mL,末读数如右图所示。
(1)冶炼铜的反应为8CuFeS2+ 21O2 高温8Cu + 4FeO + 2Fe2O3+ 16SO2,若CuFeS2中Fe的化合价为+2,反应中被还原的元素是 (填元素符号)。
(2)装置a的作用是 。
| A.有利于空气中氧气充分反应 | B.除去空气中的水蒸气 |
| C.有利于气体混合 | D.有利于观察空气流速 |
(4)滴定时,标准碘溶液所耗体积为 mL。用化学方程式表示滴定的原理: 。
(5)通过计算可知,该黄铜矿的纯度为 。
(1)Cu、O (2分); (2)BD (2分);(3)将系统装置中SO2全部排入d中充分吸收(2分)
(4)20.00 (2分);I2+ SO2+ 2H2O=H2SO4+ 2HI(3分) (5)80.00%(3分)
(4)20.00 (2分);I2+ SO2+ 2H2O=H2SO4+ 2HI(3分) (5)80.00%(3分)
试题分析:(1)若CuFeS2中Fe的化合价为+2,则铜元素和硫元素的化合价分别为+2价和-2价。根据化学方程式可知,反应后铜元素化合价降低,氧元素化合价也降低,硫元素化合价升高,铁元素化合价部分升高,因此反应中被还原的元素是Cu和O。
(2)由于空气中含有水蒸气,因此浓硫酸的作用是干燥空气。另外通过观察a装置中气泡可以控制气体的流速以便于控制反应,故答案为BD。
(3)由于装置还含有未被吸收的SO2,因此继续投入空气的目的是将系统装置中SO2全部排入d中充分吸收。
(4)根据滴定管的液面可知,读数是20.10ml,因此实际消耗标准液的体积为20.10ml-0.10ml=20.00ml。二氧化硫具有还原性,能被碘氧化生成 硫酸,反应的离子方程式为I2+ SO2+ 2H2O=H2SO4+ 2HI。
(5)消耗标准碘的物质的量=0.05000 mol·L-1×0.02000L=0.001000mol,所以根据方程式可知参加反应的二氧化硫的物质的量是0.001000mol,则样品产生的二氧化硫的物质的量是0.001000mol×10=0. 01000mol。因此根据方程式可知CuFeS2的物质的量是0.005ml,质量是0.005ml×184g/mol=0.92g,因此该黄铜矿的纯度为
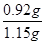 ×100%=80.00%
×100%=80.00%
练习册系列答案
相关题目
 →Fe(NO3)3+NO↑+2H2O
→Fe(NO3)3+NO↑+2H2O 与R-可发生反应:RO
与R-可发生反应:RO