题目内容
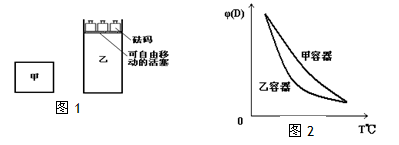
一定温度下,有可逆反应:2A(g)+2B(g) C(g)+3D(g);ΔH<0。现将2molA和2molB充入体积为V的甲容器,将2molC和6molD充入乙容器并使乙容器在反应开始前的体积为2V(如图1)。
C(g)+3D(g);ΔH<0。现将2molA和2molB充入体积为V的甲容器,将2molC和6molD充入乙容器并使乙容器在反应开始前的体积为2V(如图1)。
关于两容器中反应的说法正确的是
A.甲容器中的反应先达到化学平衡状态
B.两容器中反应均达平衡后,平衡体系中各组分的体积百分组成相同,浓度也相同
C.两容器达平衡后升高相同的温度,两容器中物质D的体积分数随温度变化如图2所示
D.在甲容器中再充入2 mol A和2 mol B,平衡后甲中c(C)是乙中c(C)的2倍
 C(g)+3D(g);ΔH<0。现将2molA和2molB充入体积为V的甲容器,将2molC和6molD充入乙容器并使乙容器在反应开始前的体积为2V(如图1)。
C(g)+3D(g);ΔH<0。现将2molA和2molB充入体积为V的甲容器,将2molC和6molD充入乙容器并使乙容器在反应开始前的体积为2V(如图1)。
关于两容器中反应的说法正确的是
A.甲容器中的反应先达到化学平衡状态
B.两容器中反应均达平衡后,平衡体系中各组分的体积百分组成相同,浓度也相同
C.两容器达平衡后升高相同的温度,两容器中物质D的体积分数随温度变化如图2所示
D.在甲容器中再充入2 mol A和2 mol B,平衡后甲中c(C)是乙中c(C)的2倍
BD
A 错误,乙中的反应等价于起始状态下的4摩尔A和4摩尔B的反应,甲恒容,乙恒压,由于该反应是气体体积数不变的反应,所以甲乙两容器自始至终各成分的浓度均相等,正逆反应速度任何时刻均相等,故甲乙两容器应同时达到化学平衡状态
B 正确 上述分析知甲乙两容器达到的平衡状态完全相同,故平衡体系中各组分的体积百分组成相同,浓度也相同
C 错误 两容器达平衡后升高相同的温度时,平衡左移两容器中物质D的体积分数随温度变化的情况也相同
D 正确 设想另有一与甲完全相同的容器,在相同条件下完成上述反应,此时平衡状态与甲应完全相同,再假想把该容器中的反应混合物挤入甲容器中,于是相当于给甲加压并使其容积减小一半,平衡不移动,但平衡混合物中各成分的浓度都增大到原来的2倍,即平衡后甲中c(C)是乙中c(C)的2倍
B 正确 上述分析知甲乙两容器达到的平衡状态完全相同,故平衡体系中各组分的体积百分组成相同,浓度也相同
C 错误 两容器达平衡后升高相同的温度时,平衡左移两容器中物质D的体积分数随温度变化的情况也相同
D 正确 设想另有一与甲完全相同的容器,在相同条件下完成上述反应,此时平衡状态与甲应完全相同,再假想把该容器中的反应混合物挤入甲容器中,于是相当于给甲加压并使其容积减小一半,平衡不移动,但平衡混合物中各成分的浓度都增大到原来的2倍,即平衡后甲中c(C)是乙中c(C)的2倍

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
 4Y(g)+Z(g),△H<0,在某温度时X的浓度随时间变化的曲线,下列有关该反应的描述正确的是
4Y(g)+Z(g),△H<0,在某温度时X的浓度随时间变化的曲线,下列有关该反应的描述正确的是
 后,反应就终止了
后,反应就终止了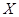 的平衡转化率为85%
的平衡转化率为85% 4C(g)达到平衡时 C的浓度为1.2 mol·L-1,当其它条件不变,把体积扩大1倍时,测得C的浓度为0.7 mol·L-1,则x的值为 ( )
4C(g)达到平衡时 C的浓度为1.2 mol·L-1,当其它条件不变,把体积扩大1倍时,测得C的浓度为0.7 mol·L-1,则x的值为 ( ) 2NH3。已知平衡时NH3的浓度是c mol·L-1,现按下列四种配比作为起始物质,分别充入上述容器,并保持温度不变,则达到平衡后,NH3的浓度不为c mol·L-1的是
2NH3。已知平衡时NH3的浓度是c mol·L-1,现按下列四种配比作为起始物质,分别充入上述容器,并保持温度不变,则达到平衡后,NH3的浓度不为c mol·L-1的是 2SO3(g);△H=-akJ·mo1-2在相同条件下要想得到2akJ热量,加入各物质的物质的量可能是( )
2SO3(g);△H=-akJ·mo1-2在相同条件下要想得到2akJ热量,加入各物质的物质的量可能是( ) N2O4(g) △H<0,升高温度该反应平衡常数增大
N2O4(g) △H<0,升高温度该反应平衡常数增大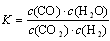 的反应,化学方程式为CO2+H2
的反应,化学方程式为CO2+H2 CO+H2O
CO+H2O 2NH3(g);△H
2NH3(g);△H <0,下列研究目的和示意图相符的是
<0,下列研究目的和示意图相符的是