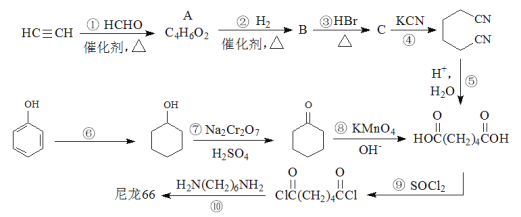
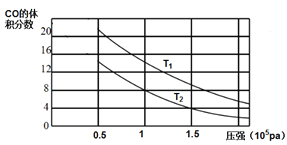
题目内容
【题目】铜及其化合物的用途非常广泛,回答下列问题:
(1)铜原子有 _____种不同运动状态的电子,亚铜离子的价电子排布式为:_____。
(2)铜能与类卤素(CN)2 反应生成 Cu(CN)2,1 mol (CN)2 分子中含有π键的数目为____,C、N 两元素可形成的离子 CN-,该离子的结构式为_____,请写出 CN-的一种等电子体_____(写化学式)。
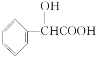
(3)CuCl2 溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子[Cu(En)2 ]2+(En 是乙二胺的简写),结构如图所示
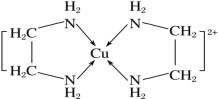
已知配合物的中心粒子的配位数指配位原子总数,则 Cu2+的配位数为_________, 该配离子中所含的非金属元素的电负性由小到大的顺序是_____;乙二胺分子中氮原子轨道的杂化类型为____,乙二胺(En)和三甲胺 [N(CH3)3 ]均属于胺类,相对分子质量相近,但乙二胺的沸点却比三甲胺的沸点高得多,其原因是:_____。
(4)某 M 原子的外围电子排布式为 3s23p5,铜与 M 形成化合物的晶胞如图所示
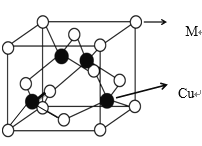
①已知铜和 M 的电负性分别为 1.9 和 3.0,则铜与 M 形成的该种化合物属于__________(填“离子”或“共价”)化合物,其化学式为__________。
②铜和形成的晶体中每个 M 原子周围最近等距的铜原子数目为_____。
③已知该晶体的晶胞参数(即立方体晶胞的棱长)为 acm,则该晶体中两个相距最近的 M 原子之间的核间距为_____pm。
【答案】29 3d10 4NA [C![]() N]- CO(或N2) 4 H<C<N sp3 乙二胺分子间能形成氢键,而三甲胺分子间不能形成氢键 共价 CuCl 4
N]- CO(或N2) 4 H<C<N sp3 乙二胺分子间能形成氢键,而三甲胺分子间不能形成氢键 共价 CuCl 4 ![]()
【解析】
(1)一个电子就是一种运动状态,铜原子是29个电子,电子排布式为[Ar]3d104s1。
(2)(CN)2的结构式为N≡C—C≡N,C、N 两元素可形成的离子CN-,根据价电子C2=N- = O,写与CN-的一种等电子体。
(3)根据结构得到Cu2+的配位数,同周期电负性从左到右逐渐增大,乙二胺分子中氮原子价层电子对数为4,乙二胺存在分子间氢键,熔沸点高。
(4)①从外围电子排布式为 3s23p5得到,电负性之差为1.1,根据结构分析得到晶胞中含有Cu、Cl个数;②以右侧面面心分析Cl与周围最近等距的铜原子数目;③晶体中两个相距最近的M 原子之间的核间距即为面对角线一半。
(1)一个电子就是一种运动状态,铜原子是29个电子,因此铜原子有29种不同运动状态的电子,电子排布式为[Ar]3d104s1,亚铜离子的价电子排布式为:3d10;故答案为:29;3d10。
(2)铜能与类卤素(CN)2反应生成Cu(CN)2,(CN)2的结构式为N≡C—C≡N,1 mol(CN)2分子中含有π键的数目为4NA,C、N 两元素可形成的离子CN-,该离子的结构式为[C![]() N]-,价电子C2=N- = O,与CN-的一种等电子体CO或N2;故答案为:4NA;[C
N]-,价电子C2=N- = O,与CN-的一种等电子体CO或N2;故答案为:4NA;[C![]() N]-;CO(或N2)。
N]-;CO(或N2)。
(3)根据结构得到Cu2+的配位数为4,同周期电负性从左到右逐渐增大,因此该配离子中所含的非金属元素的电负性由小到大的顺序是H<C<N;乙二胺分子中氮原子价层电子对数为4,因此轨道的杂化类型为sp3,乙二胺(En)和三甲胺[N(CH3)3]均属于胺类,相对分子质量相近,但乙二胺的沸点却比三甲胺的沸点高得多,其原因是乙二胺存在分子间氢键,熔沸点高;故答案为:4;H<C<N;sp3;乙二胺分子间能形成氢键,而三甲胺分子间不能形成氢键。
(4)①M原子的外围电子排布式为 3s23p5,M为Cl,铜和Cl的电负性分别为1.9和3.0,电负性之差为1.1,因此铜与Cl形成的该种化合物属于共价化合物,该晶胞中含有4个Cu,4个Cl,因此化学式为CuCl;故答案为:共价;CuCl。
②以右侧面面心分析Cl与周围最近等距的铜原子数目有4个;故答案为:4。
③已知该晶体的晶胞参数(即立方体晶胞的棱长)为acm,则该晶体中两个相距最近的M 原子之间的核间距即为面对角线一半,则为![]() pm;故答案为:
pm;故答案为:![]() 。
。