题目内容
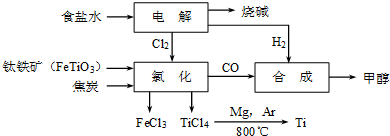
(12分)钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染。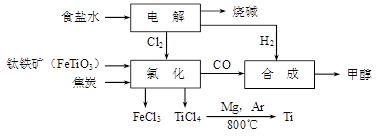
请回答下列问题:
(1)Ti的原子序数为22,Ti位于元素周期表中第_______周期,第______族。
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式 。
(3)制备TiO2的方法之一是利用TiCl4水解生成TiO2·x H2O,再经焙烧制得。水解时需加入大量的水并加热,请结合化学方程式和必要的文字说明原因:
(4)由TiCl4→Ti 需要在Ar气中进行的理由是_________________________________。反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于 ℃即可。
| | TiCl4 | Mg | MgCl2 | Ti |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
(6)由CO和H2合成甲醇的方程式是:CO(g)+2H2(g)
 CH3OH(g)。若不考虑生产过 程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H2 mol。
CH3OH(g)。若不考虑生产过 程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H2 mol。
(共12分,每小问2分)
(1)四;ⅣB(各1分)
(2)2FeTiO3+6C+7Cl2高温 2FeCl3+2TiCl4+6CO
(3)TiCl4+(2+x) H2O TiO2·xH2O+4HCl,加入大量水并加热,促进水解趋于完全(或促使水解正向进行
TiO2·xH2O+4HCl,加入大量水并加热,促进水解趋于完全(或促使水解正向进行
(4)防止钛、镁被氧化(或防止钛镁与空气、水反应),1412
(5) (或
(或 )
)
(6)5
解析试题分析:(1)Ti的原子序数为22,比K大3,跟K同周期且在K的右3个。(2)从图示可知氯化时的反应物、生成物,再根据得失电子和原子守恒即可得出该反应的方程式;(5)根据得失电子守恒:1Ti3+~1Fe3+,故n(Fe3+)=n(Ti3+)=n(TiO2)=cV×10-3mol,其质量分数为 (或
(或 )。
)。
考点:物质的相互转化和制备化学计算书写化学方程式
点评:本题是一道有关电解原理的应用知识题目,要求学生具有分析和解决问题的能力,难度较大。电解是指在电解槽中,直流电通过电极和电解质,在两者接触的界面上发生电化学反应,以制备所需产品的过程。学习电解原理应注意以下几个要点。一、注意两极的判断、两极的反应与离子方程式的书写确定电解池的阳、阴极由所接电源的正负极决定,与电极材料无关,与电源负极相联的电极为阴极,与电源正极相联的电极为阳极。阴、阳极反应:阴极:阳离子移向阴极,发生还原反应;阳极:阴离子向阳极移动,在阳极发生氧化反应,电极本身也可以发生氧化反应;离子放电顺序:阴离子:S2->I->Br->Cl->OH->含氧酸根离子;阳离子:Ag+>Cu2+>H+……。

(12分)钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染。

请回答下列问题:
(1)Ti的原子序数为22,Ti位于元素周期表中第_______周期,第______族。
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式 。
(3)制备TiO2的方法之一是利用TiCl4水解生成TiO2·x H2O,再经焙烧制得。水解时需加入大量的水并加热,请结合化学方程式和必要的文字说明原因:
(4)由TiCl4→Ti 需要在Ar气中进行的理由是_________________________________。反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于 ℃即可。
|
|
TiCl4 |
Mg |
MgCl2 |
Ti |
|
熔点/℃ |
-25.0 |
648.8 |
714 |
1667 |
|
沸点/℃ |
136.4 |
1090 |
1412 |
3287 |
(5)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。滴定分析时,称取TiO2(摩尔质量为M g/mol)试样w g,消耗c mol/L NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数为___________________。(用代数式表示)
(6)由CO和H2合成甲醇的方程式是:CO(g)+2H2(g) CH3OH(g)。若不考虑生产过 程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H2 mol。
CH3OH(g)。若不考虑生产过 程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H2 mol。
 .
.