题目内容
【题目】下列说法不正确的是( )
A. HCl、HBr、HI的熔、沸点最低的是 HCl
B. 磷原子核外有15个运动状态完全不同的电子
C. 硝酸易挥发是因为形成分子内氢键
D. 甲烷分子间也可以形成氢键
【答案】D
【解析】
A、HCl、HBr、HI形成的晶体都是分子晶体,则HCl、HBr、HI的熔、沸点依次升高与分子间作用力大小有关,选项A正确;
B、磷为15号元素,原子核外有15个运动状态完全不同的电子,选项B正确;
C、由于硝酸中存在分子内氢键使得其沸点比较低,故硝酸易挥发,选项C正确;
D、因为碳氢的电负性差别很小,甲烷里的C-H键极性很小,甲烷分子间不形成氢键,选项D不正确。
答案选D。

 春雨教育同步作文系列答案
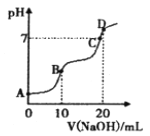
春雨教育同步作文系列答案【题目】已知下列数据:
物质 | 熔点(℃) | 沸点(℃) | 密度(g·cm-3) |
乙醇 | -117.0 | 78.0 | 0.79 |
乙酸 | 16.6 | 117.9 | 1.05 |
乙酸乙酯 | -83.6 | 77.5 | 0.90 |
某学生在实验室制取乙酸乙酯的主要步骤如下:
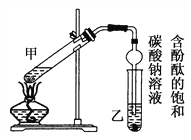
①配制2 mL浓硫酸、3 mL乙醇(含18O)和2 mL乙酸的混合溶液。
②按上图连接好装置(装置气密性良好)并加入混合液,用小火均匀加热3 min~5 min。
③待试管乙收集到一定量产物后停止加热,撤出试管乙并用力振荡,然后静置待分层。
④分离出乙酸乙酯,洗涤、干燥。
(1)反应中浓硫酸的作用是______________________________________;
写出制取乙酸乙酯的化学方程式:_____________________________。
(2)上述实验中饱和碳酸钠溶液的作用是________(填字母)。
A.中和乙酸和乙醇 B.中和乙酸并吸收乙醇
C.减少乙酸乙酯的溶解 D.加速酯的生成,提高其产率
(3)步骤②中需要小火均匀加热,其主要理由是___________________;
步骤③所观察到的现象是_____________________________________;
欲将乙试管中的物质分离以得到乙酸乙酯,必须使用的仪器有________;分离时,乙酸乙酯应从仪器________(填“下口放”或“上口倒”)出。