题目内容
3.图中横坐标均表示11~17号元素顺序排列的原子序数.根据图象变化趋势判断,纵坐标表示其最高化合价的是( )| A. | 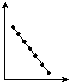 | B. |  | C. |  | D. |  |
分析 原子序数11~17号的元素,为第三周期元素,电子层数相等,随核电荷数的递增,最外层电子数增大、原子半径逐渐减小,元素最高正化合价增大.
解答 解:A.图中表示逐渐减小的变化,可能纵坐标为原子半径的变化规律,故A不选;
B.图中表示不变的规律,可能纵坐标为电子层,故B不选;
C.图中表示逐渐增大的变化,可能纵坐标为元素的最高正化合价,故C选;
D.图中表示逐渐增大的变化,但出现反常的规律,纵坐标不能表示最高化合价,故D不选;
故选C.
点评 本题考查原子结构与元素周期律,为高频考点,把握同周期元素性质的变化规律及图象分析为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
13.在乙醇发生的各种反应中,断键方式不正确的是( )
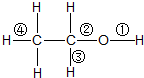

| A. | 与金属钠反应时,键①断裂 | |
| B. | 与HCl反应生成氯乙烷时,键②断裂 | |
| C. | 与醋酸、浓硫酸共热时,键②断裂 | |
| D. | 与浓硫酸共热至170℃时,键②和④断裂 |
11.反应4NH3+5O2=4NO+6H2O在5L的密闭容器中进行,30s后,NO的物质的量增加了0.3mol,则此反应的化学反应速率为( )
| A. | v(O2)=0.01mol/(L•s) | B. | v(NO)=0.008mol/(L•s) | ||
| C. | v(H2O)=0.001mol/(L•s) | D. | v(NH3)=0.002mol/(L•s) |
8.室温下,同种规格的铝片分别与下列物质混合,产生氢气速率最大的是( )
| A. | 0.1 mol/L的盐酸15mL | B. | 0.15 mol/L 的硫酸溶液8mL | ||
| C. | 0.2 mol/L 的盐酸12mL | D. | 18 mol/L的浓硫酸15mL |
15. 键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.参考以下表格的键能数据,回答下列问题:
键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.参考以下表格的键能数据,回答下列问题:
(1)比较下列两组物质的熔点高低(填“>”或“<”)
SiC>Si; SiCl4<SiO2
(2)能不能根据键能的数据判断单质Si 和化合物SiCl4的熔点高低?不能(填“能”或“不能”),原因是物质熔点高低由构成物质的微粒间作用力决定,单质Si属于原子晶体,原子间作用力是共价键;SiCl4属于分子晶体,分子间作用力是范德华力,比共价键弱得多.因此不能都根据键能来判断物质的熔点高低
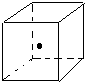
(3)如图立方体中心的“•”表示金刚石晶体中的一个原子,请在立方体的顶点用“•”表示出与之紧邻的碳原子
(4)工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)$\frac{\underline{\;高温\;}}{\;}$ Si(s)+4HCl(g)计算该反应的反应热△H为+236kJ/mol.
 键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.参考以下表格的键能数据,回答下列问题:
键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.参考以下表格的键能数据,回答下列问题:| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ•mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
SiC>Si; SiCl4<SiO2
(2)能不能根据键能的数据判断单质Si 和化合物SiCl4的熔点高低?不能(填“能”或“不能”),原因是物质熔点高低由构成物质的微粒间作用力决定,单质Si属于原子晶体,原子间作用力是共价键;SiCl4属于分子晶体,分子间作用力是范德华力,比共价键弱得多.因此不能都根据键能来判断物质的熔点高低
(3)如图立方体中心的“•”表示金刚石晶体中的一个原子,请在立方体的顶点用“•”表示出与之紧邻的碳原子
(4)工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)$\frac{\underline{\;高温\;}}{\;}$ Si(s)+4HCl(g)计算该反应的反应热△H为+236kJ/mol.
13.以菱镁矿(主要成分为MgCO3,含少量FeCO3 )为原料制备高纯氧化镁的实验流程如下:
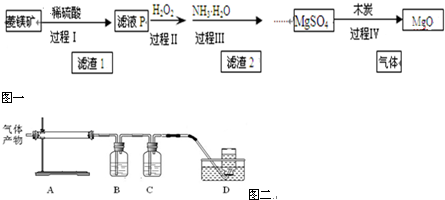
(1)滤液P中含有的阳离子有H+、Fe2+、Mg2+.
(2)过程Ⅱ中发生的氧化还原反应的离子方程式是2Fe2++H2O2+2H+═2Fe3++2H2O.
(3)已知:
过程Ⅲ中加入NH3•H2O调节溶液pH约为4,其目的是使Fe3+沉淀完全而Mg2+不沉淀.
(4)过程Ⅳ在800℃煅烧MgSO4,发生多个反应,产物除MgO外,还有SO2、CO2、CO、S等气体产物,利用右图装置判断煅烧产生的气体.
①A中试管壁附着有淡黄色固体,该固体的化学式是S.
②B中盛放的溶液是(填字母)d.
a.NaOH 溶液 b.Na2CO3 溶液
c.稀硝酸 d.KMnO4溶液
③写出800℃煅烧MgSO4,产生气体产物是S 和CO的化学方程式MgSO4+3C$\frac{\underline{\;800℃\;}}{\;}$MgO+S↑+3CO↑.

(1)滤液P中含有的阳离子有H+、Fe2+、Mg2+.
(2)过程Ⅱ中发生的氧化还原反应的离子方程式是2Fe2++H2O2+2H+═2Fe3++2H2O.
(3)已知:
| Mg(OH)2 | Fe(OH)3 | Fe(OH)2 | |
| 开始沉淀的pH | 10.4 | 1.9 | 7.0 |
| 沉淀完全的pH | 12.4 | 3.2 | 9.0 |
(4)过程Ⅳ在800℃煅烧MgSO4,发生多个反应,产物除MgO外,还有SO2、CO2、CO、S等气体产物,利用右图装置判断煅烧产生的气体.
①A中试管壁附着有淡黄色固体,该固体的化学式是S.
②B中盛放的溶液是(填字母)d.
a.NaOH 溶液 b.Na2CO3 溶液
c.稀硝酸 d.KMnO4溶液
③写出800℃煅烧MgSO4,产生气体产物是S 和CO的化学方程式MgSO4+3C$\frac{\underline{\;800℃\;}}{\;}$MgO+S↑+3CO↑.
 A是一种常见的半导体材料,E是一种白色沉淀.存在下列物质转化关系,据此填写下列空白.
A是一种常见的半导体材料,E是一种白色沉淀.存在下列物质转化关系,据此填写下列空白.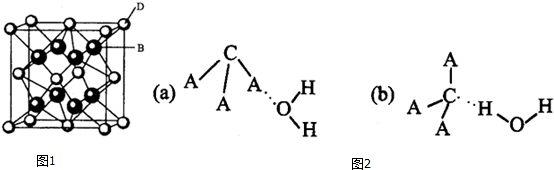
 ;该离子化合物晶体的密度为ag•cm-3.,则晶胞的体积是$\frac{\frac{78}{{N}_{A}}×4}{a}$(只要求列出算式).
;该离子化合物晶体的密度为ag•cm-3.,则晶胞的体积是$\frac{\frac{78}{{N}_{A}}×4}{a}$(只要求列出算式).