题目内容
9.下列说法正确的是( )| A. | 1 L 1 mol•L-1 Na2CO3溶液中含有NA个C原子 | |
| B. | 标准状况下,0.1 mol Cl2 溶于水,转移的电子数目为0.1NA | |
| C. | 常温下,向饱和Na2CO3溶液中加入少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,说明常温下Ksp(BaCO3)<Ksp(BaSO4) | |
| D. | 侯氏制碱法是将二氧化碳和氨气先后通入饱和氯化钠溶液中,制得碳酸氢钠固体,再在高温下灼烧,转化为碳酸钠固体 |
分析 A.根据C原子守恒判断;
B.氯气与水的反应为可逆反应;
C.饱和Na2CO3溶液中加少量BaSO4粉末,生成沉淀,应满足Qc(BaCO3)>Ksp(BaCO3);
D.二氧化碳溶解度较小,应先通入氨气.
解答 解:A.1 L 1 mol•L-1 Na2CO3溶液中,n(CO32-)+n(HCO3-)+n(H2CO3)=1mol,则含有NA个C原子,故A正确;
B.氯气与水的反应为可逆反应,则转移的电子数目小于0.1NA,故B错误;
C.饱和Na2CO3溶液中加少量BaSO4粉末,Qc(BaCO3)>Ksp(BaCO3),为沉淀的生成,不发生沉淀的转化,不能比较Ksp,故C错误;
D.联合制碱法原理是向氨化的饱和氯化钠溶液中通入足量的二氧化碳,使溶解度较小的碳酸氢钠从溶液中析出,其反应的化学方程式为:NaCl+CO2+NH3+H2O═NH4Cl+NaHCO3,制得碳酸氢钠,再在高温下灼烧,转化为碳酸钠,故D错误.
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握盐类水解、物质的制备、沉淀生成及转化、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
17.现有部分短周期元素的性质或原子结构如表:
(1)X3Y、X2T、XZ都是离子化合物,这三种化合物中所涉及离子的半径由大到小的顺序是Cl->S2->N3->Na+(用离子符号表示).
(2)T与Z的氢化物的稳定性:HCl>H2S(填化学式),依据是Cl的非金属性大于S,则HCl的稳定性大于H2S.
(3)写出W的单质与X的最高价氧化物对应的水化物反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(4)Y的一种液态氢化物Y2H4具有强还原性,能与溴化银反应生成黑色银粒,本身被氧化成Y单质,写出发生反应的化学方程式:N2H4+4AgBr=4Ag+N2↑+4HBr,该反应中氧化产物的电子式为 .
.
| 元素 | 元素性质或原子结构 |
| T | 元素最高正价是+6 |
| X | 在短周期元素中原子半径最大 |
| Y | 氢化物与最高价氧化物对应的水化物反应生成盐 |
| Z | M层上有7个电子 |
| W | 其单质既能跟酸反应,又能跟碱反应,且都产生H2 |
(2)T与Z的氢化物的稳定性:HCl>H2S(填化学式),依据是Cl的非金属性大于S,则HCl的稳定性大于H2S.
(3)写出W的单质与X的最高价氧化物对应的水化物反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(4)Y的一种液态氢化物Y2H4具有强还原性,能与溴化银反应生成黑色银粒,本身被氧化成Y单质,写出发生反应的化学方程式:N2H4+4AgBr=4Ag+N2↑+4HBr,该反应中氧化产物的电子式为
 .
.
19.下列离子方程式书写正确的是( )
| A. | 向苯酚钠溶液中通入少量CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3- | |
| B. | Fe(OH)3沉淀被氢碘酸溶解:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 向Ca(HCO3)2溶液中加入少量NaOH:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| D. | 用铜电极电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- |





 ;
; .
.

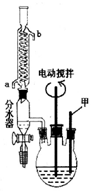 苯甲酸(C6H5COOH式量:122,熔点122.4℃,密度为1.2659g•cm-3)是一种一元有机弱酸,微溶于水易溶于乙醇.实验室中由甲苯(式量:92,密度为0.8669g•cm-3)制备苯甲酸的实验如下:
苯甲酸(C6H5COOH式量:122,熔点122.4℃,密度为1.2659g•cm-3)是一种一元有机弱酸,微溶于水易溶于乙醇.实验室中由甲苯(式量:92,密度为0.8669g•cm-3)制备苯甲酸的实验如下: