题目内容
【题目】将3.64 g Fe2O3和Al2O3的混合物溶于200 mL 0.1 mol/L盐酸中(盐酸过量),再向该溶液中加入NaOH溶液使Fe3+和Al3+恰好完全沉淀,用去NaOH溶液100 mL。则NaOH溶液的物质的量浓度是( )
A. 0.1 mol/L B. 0.2 mol/L C. 0.4 mol/L D. 0.8 mol/L
【答案】B
【解析】
反应生成硫酸铝、硫酸铁,盐酸有剩余,向反应后的混合溶液中加入10 mL NaOH溶液,恰好使Fe3+、Al3+完全沉淀,此时溶液中溶质为NaCl,根据钠离子守恒有n(NaOH)=n(NaCl),根据氯离子守恒有n(NaCl)=n(HCl),据此计算n(NaOH),再根据c=![]() 来分析计算。
来分析计算。
盐酸的浓度为0.1 mol/L,体积为0.2L,则其中氯离子的物质的量为0.02mol.
Fe2O3、Al2O3与硫酸反应生成硫酸铝、硫酸铁,硫酸有剩余,向反应后的混合溶液中加入10 mL NaOH溶液,恰好使Fe3+、Al3+完全沉淀,此时溶液中溶质为NaCl,
根据氯离子守恒有n(NaCl) = n(HCl) = 0.2 L×0.1 mol/L = 0.02 mol,
根据钠离子守恒可得:n(NaOH) = n(NaCl) = 0.02 mol,则该c(NaOH) = ![]() = 0.2 mol/L,
= 0.2 mol/L,
答案选B。

 阅读快车系列答案
阅读快车系列答案【题目】四种常见元素的性质或结构信息如下表。试根据信息回答有关问题。
元素 | A | B | C | D |
性质结构信息 | 原子核外有两个电子层,最外层有3个未成对的电子 | 原子的M层有1对成对的p电子 | 原子核外电子排布为[Ar]3d104sx,有+1、+2两种常见化合价 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
(1)写出B原子的电子排布式__________
(2)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为__________,简要描述该配合物中化学键的成键情况:__________
(3)“。”表示氢原子,小黑点“·”表示没有形成共价键的最外层电子,短线表示共价键。

则在以上分子中,中心原子采用sp3杂化形成化学键的是__________(填序号);在②的分子中有__________个σ键和__________个π键
(4)硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如下图所示:
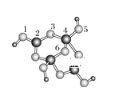
在Xm-中,硼原子轨道的杂化类型有__________;配位键存在于__________原子之间(填原子的数字标号);m=__________(填数字)
(5)Co(NH3)5BrSO4可形成两种钴的配合物,已知Co3+的配位数是6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物的溶液中加BaCl2溶液时,产生白色沉淀;在第二种配合物溶液中加入BaCl2溶液时,则无明显现象,则第一种配合物的化学式为__________,第二种配合物的化学式为_________ .