题目内容
【题目】A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等。且含B元素物质的大量燃烧是形成酸雨的主要原因之一。

(1)写出A、B、C三种元素的名称___、_____、___。
(2)A元素位于元素周期表中第___周期,第___族。
(3)B的原子结构示意图为___,用电子式表示元素B的钠盐的形成过程:___。
(4)由元素A、C及氢元素形成的化合物中含有的化学键的类型有___。
(5)A和C氢化物哪个更稳定:________(写出该氢化物的化学式)
【答案】 氮 硫 氟 二 V A 
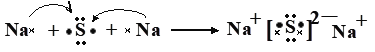 离子键、极性共价键 HF
离子键、极性共价键 HF
【解析】由A、B、C为短周期元素,结合在周期表中所处的位置可知,A、C为第二周期元素,设A的质子数为x,C的质子数为x+2,B的质子数为x+9,A、C两元素的原子核外电子数之和等于B原子的质子数,则x+x+2=x+9,解得x=7,即A为N,C为F,B原子核内质子数和中子数相等,B为S,S燃烧生成二氧化硫可导致酸雨发生;
(1)由上述分析可知,A、B、C的名称分别为氮、硫、氟;
(2)A为N,位于元素周期表中第二周期第VA族;
(3)B为S,质子数为16,其原子结构示意图为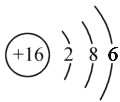 ,用电子式表示元素B的钠盐的形成过程为
,用电子式表示元素B的钠盐的形成过程为![]() ;
;
(4)由元素A、C及氢元素形成的化合物为NH4F,含有的化学键的类型有离子键、极性共价键;
(5)非金属性越强,对应氢化物越稳定,非金属性F>N,则A和C氢化物中HF更稳定。

练习册系列答案
相关题目

