题目内容
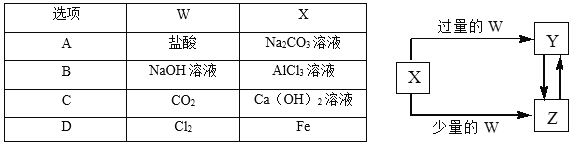
【题目】将一定质量的镁、铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3mol·L-1 的NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述中正确的是
A. 开始加入合金的质量可能为16.4g
B. 标准状况下产物NO的体积为22.4L
C. 生成沉淀完全时消耗NaOH溶液的体积为100mL
D. 参加反应的硝酸的物质的量为0.1mol
【答案】C
【解析】试题分析:将一定量的镁和铜合金加入到稀HNO3中,二者恰好反应,金属、硝酸都没有剩余,反应中还原产物只有NO,发生反应:3Mg+8HNO3(稀)═3Mg(NO3)2+2NO↑+4H2O、3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O;向反应后的溶液中加入3mol/LNaOH溶液至沉淀完全,发生反应:Mg(NO3)2+2NaOH═Mg(OH)2↓+2NaNO3、Cu(NO3)2+2NaOH═Cu(OH)2↓+2NaNO3,沉淀为氢氧化镁和氢氧化铜,生成沉淀的质量比原合金的质量增加5.1g,则氢氧化镁和氢氧化铜含有氢氧根的质量为5.1g,氢氧根的物质的量为![]() =0.3mol,根据电子转移守恒,则镁和铜的总的物质的量为
=0.3mol,根据电子转移守恒,则镁和铜的总的物质的量为![]() =0.15mol,生成NO为
=0.15mol,生成NO为![]() =0.1mol。A、镁和铜的总的物质的量为0.15mol,假定全为镁,质量为0.15mol×24g/mol=3.6g,若全为铜,质量为0.15mol×64g/mol=9.6g,所以参加反应的金属的总质量(m)为3.6g<m<9.6g,故A错误;B、标况下NO的体积为0.1mol×22.4L/mol=2.24L,故B错误;C、加入的氢氧化钠恰好与硝酸镁、硝酸铜反应,由上述分析可知,加入的NaOH为0.3mol,故加入NaO溶液的体积为
=0.1mol。A、镁和铜的总的物质的量为0.15mol,假定全为镁,质量为0.15mol×24g/mol=3.6g,若全为铜,质量为0.15mol×64g/mol=9.6g,所以参加反应的金属的总质量(m)为3.6g<m<9.6g,故A错误;B、标况下NO的体积为0.1mol×22.4L/mol=2.24L,故B错误;C、加入的氢氧化钠恰好与硝酸镁、硝酸铜反应,由上述分析可知,加入的NaOH为0.3mol,故加入NaO溶液的体积为![]() =0.1L=100mL,故C正确;D、根据方程式可知参加反应的n反应(HNO3)=
=0.1L=100mL,故C正确;D、根据方程式可知参加反应的n反应(HNO3)=![]() n(金属)=
n(金属)=![]() ×0.15mol=0.4mol,故D错误;故选C。
×0.15mol=0.4mol,故D错误;故选C。

 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案【题目】我国古代文献资料中记数了大量的化学研究过程与成果。下列选项不涉及化学变化的是
选项 | A | B | C | D |
原文 | 欲去杂还纯,再入水煎炼,倾入盆中,经宿成白雪 | 以曾者涂铁,铁赤色如铜 | 丹砂烧之成水银,积变又还成丹砂 | 水火既济而土合 |
解释 | 重结晶方法提纯物质 | 金属的置换 | 物质间转化的可逆性 | 黏土烧结成陶瓷 |
A. A B. B C. C D. D
【题目】
I.某化学兴趣小组对下列三组物质进行研究:
A.HCl、H2SO4、H2CO3、HNO3
B.溶液、水、悬浊液、胶体
C.Na2CO3、NaNO3、AgNO3、Ba(NO3)2
请你帮他们完善下列空白:
A | B | C | |
分类标准 | 含氧酸 | 分散系 | (3) |
不属于该类别的物质 | (1) | (2) | Na2CO3 |
II.“探险队员”——盐酸,不小心走进了化学迷宫,不知怎样走出来,因为迷宫有许多“吃人的野兽”(即能与盐酸反应的物质),盐酸必须避开它们,否则就无法通过。
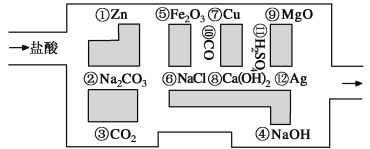
(1)请你帮助它走出迷宫(请用图中物质前的序号连接起来表示所走的路线):________________。
(2)在能“吃掉”盐酸的化学反应中,属于酸和碱中和反应的有________个,其中能“吃掉”盐酸的盐是____________,写出该反应的离子方程式 。