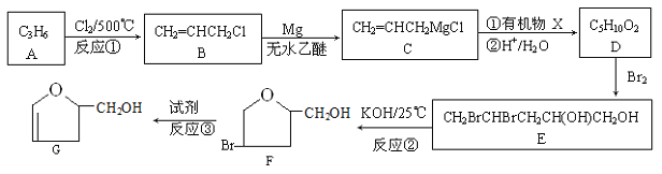
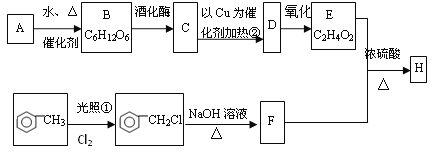
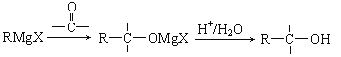题目内容
【题目】设NA表示阿伏加德罗常数,下列叙述中正确的是( )
A、 5.6 g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA
B、常温常压下,22.4L的D2、H2组成的气体分子数约为NA
C、标准状况下,22.4LSO3中含有的氧原子数约为3 NA
D、1mol Cl2与足量NaOH溶液反应转移的电子数NA
【答案】D
【解析】A项:由2Fe+3Cl2![]() 2FeCl3可知氯气不足,故反应中转移电子数为0.2NA
2FeCl3可知氯气不足,故反应中转移电子数为0.2NA
B项:本题不适应的标况下的气体摩尔体积
C项:标况下,SO3非气态,不适应标况下的气体摩尔体积。
D项:Cl2+2NaOH=NaCl +NaClO+ H2O为自身岐化反应,每有1mol Cl2反应有1 mol电子转移,正确。

练习册系列答案
相关题目
【题目】某温度下,在甲、乙、丙、丁四个恒容密闭容器中投入H2和I2,发生反应:H2 (g) +I2 (g)![]() 2HI(g).反应体系中各物质浓度的有关数据如下。
2HI(g).反应体系中各物质浓度的有关数据如下。
容器 | 起始浓度 | 平衡浓度 | |
c(H2)/mol·L-1 | c(I2)/mol·L-1 | c(HI)/mol·L-1 | |
甲 | 0.01 | 0.01 | 0.004 |
乙 | 0.01 | 0.02 | a |
丙 | 0.02 | 0.01 | b |
丁 | 0.02 | 0.02 | —— |
下列判断正确的是
A. HI的平衡浓度:a=b>0.004
B. 平衡时,H2的转化率:丁>甲
C. 平衡时,乙中H2的转化率等于20%
D. 丙中条件下,该反应的平衡常数K=4