题目内容
4.Fe2O3、Cu2O、Cu都是红色固体.已知:Cu2O+2H+=Cu+Cu2++H2O
(1)若将上述红色固体纯净物溶于稀硫酸,得到蓝色溶液,则该红色固体是Cu2O(填化学式).
(2)16.0gFe2O3恰好完全溶于100mL足量的氢碘酸溶液中,则反应的离子方程式为Fe2O3+6H++2I-=I2+2Fe2++3H2O,该氢碘酸溶液的浓度为6mol•L-1.
(3)将一包Fe2O3和Cu的混合物恰好完全溶于150mL2mol•L-1H2SO4溶液,取少量反应后的溶液于试管中,滴加KSCN溶液,溶液没有明显颜色变化,反应后没有固体物质.写出反应发生氧化还原的离子方程式:2Fe3++Cu=Cu2++2Fe2+;该混合物中Fe2O3和Cu的质量之比为5:2.
(4)Fe2O3、Cu2O和Cu组成的混合物溶于稀硫酸中,若反应后有大量的固体剩余,则溶液中一定不能大量存在的金属离子是Fe3+(填离子符号,下同);若反应后溶液中有大量的Fe3+存在,则溶液中还含有的金属离子是Cu2+.
分析 (1)若将上述红色固体纯净物溶于稀硫酸,得到蓝色溶液,说明生成了铜离子,不含铜和氧化铁;
(2)16.0gFe2O3恰好完全溶于100mL足量的氢碘酸溶液中,发生氧化还原反应生成碘单质、亚铁离子和水,结合反应定量关系计算碘化氢的浓度;
(3)将一包Fe2O3和Cu的混合物恰好完全溶于150mL2mol•L-1H2SO4溶液,发生反应Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,Fe2(SO4)3+Cu=CuSO4+2FeSO4,取少量反应后的溶液于试管中,滴加KSCN溶液,溶液没有明显颜色变化,反应后没有固体物质,证明铁生成了硫酸亚铁,铜生成了硫酸铜,结合反应化学方程式定量关系计算;
(4)Fe2O3、Cu2O和Cu组成的混合物溶于稀硫酸中,若反应后有大量的固体剩余判断为铜,溶液中一定不存在的是铁离子;若反应后溶液中有大量的Fe3+存在,则溶液中还含有的金属离子是Fe2+、Cu2+.
解答 解:(1)若将上述红色固体纯净物溶于稀硫酸,得到蓝色溶液,Cu2O+2H+=Cu+Cu2++H2O,铜和稀硫酸不反应,氧化铁溶于硫酸生成硫酸铁溶于为黄色,则该红色固体是Cu2O,故答案为:Cu2O;
(2)16.0gFe2O3恰好完全溶于100mL足量的氢碘酸溶液中,发生氧化还原反应生成碘单质、亚铁离子和水,反应的离子方程式为:Fe2O3+6H++2I-=I2+2Fe2++3H2O,
16.0gFe2O3物质的量=$\frac{16.0g}{160g/mol}$=0.1mol,则HI物质的量为0.6mol,该氢碘酸溶液的浓度=$\frac{0.6mol}{0.1L}$=6mol/L,故答案为:6;
(3)将一包Fe2O3和Cu的混合物恰好完全溶于150mL2mol•L-1H2SO4溶液,发生反应:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,Fe2(SO4)3+Cu=CuSO4+2FeSO4,反应发生氧化还原的离子方程式为:2Fe3++Cu=Cu2++2Fe2+,取少量反应后的溶液于试管中,滴加KSCN溶液,溶液没有明显颜色变化,反应后没有固体物质,证明铁生成了硫酸亚铁,铜生成了硫酸铜,结合反应化学方程式定量关系计算,Fe2O3~Fe2(SO4)3~Cu~CuSO4~2FeSO4,原混合物中Fe2O3和Cu的物质的量相同,设物质的量为x,依据硫酸根守恒得到:2x+x=0.150L×2mol•L-1,x=0.1mol,该混合物中Fe2O3和Cu的质量之比=160×0.1::64×0.1=5:2,
故答案为:5:2;
(4)Fe2O3、Cu2O和Cu组成的混合物溶于稀硫酸中,Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,Cu2O+2H+=Cu+Cu2++H2O,若反应后有大量的固体剩余判断为铜,溶液中一定不存在的是铁离Fe3+;若反应后溶液中有大量的Fe3+存在,的不存在,发生反应离子方程式为:2Fe3++Cu=Cu2++2Fe2+,则铜则溶液中还含有的金属离子是Fe2+、Cu2+,
故答案为:Fe3+;Fe2+、Cu2+.
点评 本题考查了物质性质、氧化还原反应、离子反应现象、离子反应的定量关系计算、离子共存分析判断等知识点,掌握基础是解题关键,题目难度中等.

 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案| A. | 水中 | B. | CCl4中 | C. | 敞口容器中 | D. | 煤油中 |
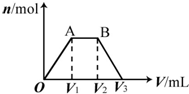 有KOH和Ca(OH)2的混合溶液,pH=13.取此溶液500mL,向其中通入CO2,通入CO2的体积(V)和生成沉淀的物质的量(n)的关系如图所示.图中(V1)为112mL(标准状况),则图中V2、V3的体积(单位为mL)分别是( )
有KOH和Ca(OH)2的混合溶液,pH=13.取此溶液500mL,向其中通入CO2,通入CO2的体积(V)和生成沉淀的物质的量(n)的关系如图所示.图中(V1)为112mL(标准状况),则图中V2、V3的体积(单位为mL)分别是( )| A. | 560、672 | B. | 1008、1120 | C. | 2240、2352 | D. | 392、504 |
| 选项 | 实验目的 | 方案 |
| A | 除去乙酸乙酯中的乙酸 | 用NaOH溶液洗涤,分液,然后干燥 |
| B | 除去葡萄糖溶液中的乙醇 | 用KMnO4氧化,再蒸馏 |
| C | 检验食盐中是否添加KIO3 | 食盐溶解,然后加入淀粉溶液 |
| D | 测定醋酸溶液浓度 | 酚酞作指示剂,用标准NaOH溶液滴定 |
| A. | A | B. | B | C. | C | D. | D |

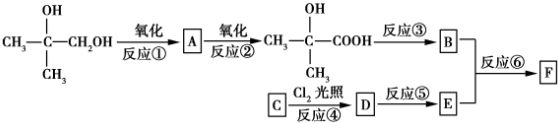
 .
. .
.
 (1)有两种气体单质Am和Bn.已知7.2g Am和6.3g Bn所含的原子个数相同,分子个数之比却为2:3.又知A原子中L电子层含电子数是K电子层的3倍.通过计算回答:写出B的元素名称氮
(1)有两种气体单质Am和Bn.已知7.2g Am和6.3g Bn所含的原子个数相同,分子个数之比却为2:3.又知A原子中L电子层含电子数是K电子层的3倍.通过计算回答:写出B的元素名称氮