题目内容
下列排序正确的是( )
| A.酸性:H2CO3<C6H5OH<CH3COOH | B.碱性:Ba(OH)2<Ca(OH)2<KOH |
| C.熔点:MgBr2<SiCl4<BN | D.沸点:PH3<NH3<H2O |
D
根据物质的有关性质逐项分析。A.由化学方程式CO2+C6H5ONa+H2O=C6H5OH+NaHCO3可知,酸性H2CO3>C6H5OH。B.Ba和Ca同主族,元素金属性Ba>Ca,故碱性Ba(OH)2>Ca(OH)2。C.SiCl4为分子晶体,MgBr2为离子晶体,BN为原子晶体,故SiCl4的熔点最低。D.因为NH3分子间存在氢键使其沸点高于PH3,H2O分子间的氢键强于NH3,使H2O的沸点更高(或根据H2O常温下为液态,而NH3为气态判断)。
点拨:知识:比较酸性、碱性及物质的熔沸点。能力:根据所学相关规律、方法分析问题的能力。试题难度:中等。
点拨:知识:比较酸性、碱性及物质的熔沸点。能力:根据所学相关规律、方法分析问题的能力。试题难度:中等。

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案
相关题目

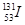 )和碘-127(
)和碘-127(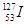 )说法正确的是( )
)说法正确的是( )