题目内容
【题目】以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等。实验室模拟工业以硫酸渣制备铁红(Fe2O3),过程如下:
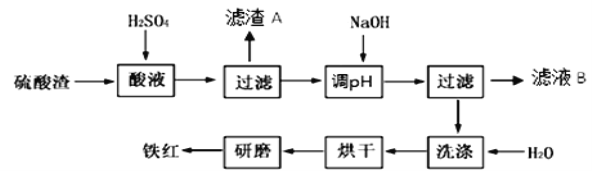
(1)硫酸渣的成分中既能与酸又能与碱反应的是 ,写出酸溶过程Fe2O3与稀硫酸反应的离子反应方程式: 。
(2)生产过程中,为了确保铁红的纯度,氧化过程需要调节溶液的pH的范围是
(部分阳离子以氢氧化物形式沉淀时溶液的pH见下表)
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 |
完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 |
(3)滤渣A的主要成分为 ,滤液B含有的主要物质有 。
(4)如何证明洗涤环节充分洗净 。
(5)已知硫酸渣质量为a kg,假设铁红制备过程中铁元素损耗25%,最终得到铁红的质量为b kg,则原来硫酸渣中铁元素质量分数为 。(用题中所给数据计算并用最简整数比表示结果)
【答案】(1) Al2O3 Fe2O3 + 6H+ ==2Fe3+ + 3H2O
(2)3.2—3.8 (3) SiO2 Na2SO4、MgSO4、Al2(SO4)3
(4)取少许最后一次洗涤滤液,滴入1~2滴Ba(NO3)2溶液,若不出现白色浑浊,表示已洗涤完全(合理即可)
(5)铁红制备过程中铁元素的质量为(b×112/160)÷75%=14b/15,则原来硫酸渣中铁元素质量分数为14b/15a。
【解析】
试题分析:(1)Al2O3为两性氧化物,硫酸渣的成分中属于两性氧化物的是Al2O3;Fe2O3与稀硫酸反应生成Fe2(SO4)3和H2O,离子方程式为:Fe2O3 + 6H+ ==2Fe3+ + 3H2O。
(2)根据题目所给表中数据可以看出,Fe3+完全沉淀而其它离子还未沉淀的pH范围是:3.2—3.8。
(3)硫酸渣中SiO2不与H2SO4反应,所以滤渣A的主要成分为SiO2;加入NaOH调节pH后,Fe3+转化为Fe(OH)3沉淀,其它离子仍为硫酸盐,所以滤液B可以回收的物质有: Na2SO4 Al2(SO4)3 MgSO4
(4)用蒸馏水洗涤沉淀的方法为:沿玻璃棒向漏斗(过滤器)的沉淀加蒸馏水至淹没沉淀,静置使液体自然流出,重复操作数次(3次)至沉淀洗涤干净。
(5)m kg铁红含铁元素:b×112/160, 原来硫酸渣中铁元素质量分数为: b×112/160÷(1-25%)÷a=14b/15a。

 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案