题目内容
设NA为阿伏加德罗常数,常压下H2S在一定量O2中燃烧。下列说法肯定错误的是
| A.110℃时,若反应前混合气体共NA个分子,反应后得到0.65NA个气体分子 |
| B.110℃时,2NA个H2S分子与氧气恰好反应完,所得气体的相对分子质量为20 |
| C.0℃时,若生成2.24L刺激性气体,则转移电子数为0.8NA |
| D.若得到的氧化产物有NA个原子,则参加反应的反应物分子有NA个 |
A
解析试题分析: A.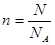 H2S与O2反应的方程式为2H2S+3O2
H2S与O2反应的方程式为2H2S+3O2 2SO2 +2H2O或2H2S+O2
2SO2 +2H2O或2H2S+O2 2S+2H2O。在110℃时水为气体。若只发生①反应则反应后N=0.6NA个气体分子,若只发生②反应,则反应后N=0.67NA个气体分子.若发生上述两个反应则气体分子的个数就在0.6NA~0.67NA之间。错误。B. 110℃时水为气体。若只发生①反应,则混合气体的相对分子质量为(2×34+3×32)÷4=41;若只发生②反应,则此时只有水蒸气,相对分子质量为18.只要数值在18~41之间均符合题意。正确。C.0℃时水为液体或固体。V(SO2)=2.24L.因为在反应的过程中,S的价态变化为-2——+4,升高6价,所以发生①产生该气体转移电子0.6NA。若还有部分发生②反应则可能共转移电子数为0.8NA。正确。D.在上述两个反应中S或SO2为氧化产物。因此根据上述两个反应的微粒变化个数关系,则有可能是若得到的氧化产物有NA个原子,则参加反应的反应物分子有NA个。正确。
2S+2H2O。在110℃时水为气体。若只发生①反应则反应后N=0.6NA个气体分子,若只发生②反应,则反应后N=0.67NA个气体分子.若发生上述两个反应则气体分子的个数就在0.6NA~0.67NA之间。错误。B. 110℃时水为气体。若只发生①反应,则混合气体的相对分子质量为(2×34+3×32)÷4=41;若只发生②反应,则此时只有水蒸气,相对分子质量为18.只要数值在18~41之间均符合题意。正确。C.0℃时水为液体或固体。V(SO2)=2.24L.因为在反应的过程中,S的价态变化为-2——+4,升高6价,所以发生①产生该气体转移电子0.6NA。若还有部分发生②反应则可能共转移电子数为0.8NA。正确。D.在上述两个反应中S或SO2为氧化产物。因此根据上述两个反应的微粒变化个数关系,则有可能是若得到的氧化产物有NA个原子,则参加反应的反应物分子有NA个。正确。
考点:考查H2S的完全氧化、不完全氧化过程中的电子转移、平均相对分子质量及微粒数的关系的知识。

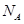 代表阿伏加德罗常数,下列说法不正确的是
代表阿伏加德罗常数,下列说法不正确的是
A.标准状况下,11.2L氯仿(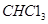 )中含有 )中含有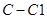 键的数目为1.5 键的数目为1.5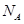 |
B.常温常压下,17g甲基(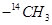 )所含的电子数为9 )所含的电子数为9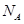 |
| C.同温同压下,1LNO和1LO2充分混合体积小于1.5L |
D.pH=l的醋酸溶液100mL中氢离子数为0.01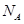 |
用装有NH3和空气的甲、乙、丙烧瓶分别做喷泉实验,实验结束后,甲、乙、丙烧瓶中溶液的体积依次为烧瓶体积的四分之三、一半和四分之一。若忽略溶质扩散,甲、乙、丙三个烧瓶中氨水的物质的量浓度之比约为
| A.1:1:1 | B.3:2:1 | C.1:2:3 | D.2:3:6 |
下列各项中,两种物质间反应均产生1 mol气体时,参加反应的酸的物质的量最少的是
| A.碳与浓硝酸 | B.铜与浓硫酸 | C.锌与稀硫酸 | D.二氧化锰与浓盐酸 |
用NA表示阿伏加德罗常数的值,下列说法错误的是( )
| A.在标准状况下22.4L H2中含有氢分子的个数为2NA |
| B.24g Mg变为Mg2+时失去的电子数为2NA |
| C.32g O2中含有氧原子的个数为2NA |
| D.1L 1mol/L NaCl溶液中含有钠离子的个数为NA |
某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成。进行如下实验: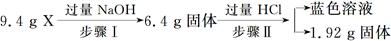
下列有关说法正确的是( )
| A.步骤Ⅰ中减少的3 g固体一定是混合物 |
| B.步骤Ⅱ中质量减少的物质一定是Cu |
| C.根据步骤Ⅰ、Ⅱ可以判断混合物X的成分为Al2O3、Fe2O3、Cu、SiO2 |
| D.根据上述步骤Ⅱ可以得出m(Fe2O3)∶m(Cu)=1∶1 |
将质量分数为a%、物质的量浓度为c1 mol·L-1的稀H2SO4蒸发掉一定量的水,使其质量分数为2a%。此时溶液的物质的量浓度为c2 mol·L-1。则c1和c2的关系是( )
| A.c1=2c2 | B.c2<2c1 |
| C.c2>2c1 | D.c2=2c1 |
氢元素与其他元素形成的二元化合物称为氢化物,下面关于氢化物的叙述正确的是
| A.H2O2分子中只存在极性键 |
B.NH3的结构式为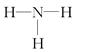 |
C.HCl的电子式为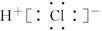 |
D.H2O的比例模型为 |
