题目内容
一定温度下,将3molA气体和1molB气体通过一密闭容器中,发生如下反应: 3A(g)+B (g) xC(g)。若容器体积固定为2L,反应1min时测得剩余1.8molA,C的浓度为0.4mol/L。请填写下列空白:
xC(g)。若容器体积固定为2L,反应1min时测得剩余1.8molA,C的浓度为0.4mol/L。请填写下列空白:
(1) x= ; 1min内,B的平均反应速率为_________;
(2)若反应经2min达到平衡,平衡时C的浓度_________0.8mol/L(填“大于”、“等于”或“小于”);
(3)平衡混合物中,C的体积分数为22%,若维持容器压强不变,达到平衡时C的体积分数_________22%,(填“大于”、“等于”或“小于”);
(4)若改变起始物质加入的量,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n (B)、n(C)之间应满足的关系式__________________ 。
(1)2 0.2 mol/(L·min); (2) 小于
(3)大于 (4)n(A)+3n(C)/2=3 n(B)+ n(C)/2=1。
解析试题分析:
3A(g) + B (g)  xC(g)
xC(g)
起始 3 1 0
转化 1.2 0.4 0.4×2=0.8
1min 1.8 0.6
所以x=2 B的平均反应速率为0.2 mol/(L·min)
(2)1min是C的浓度为0.4mol/L,2min平衡时随反应浓度降低,反应速率减慢,因此C的浓度小于0.8 mol/L。
(3)若维持容器压强不变,需要缩小容器体积,有利于反应正向移动,因此C的体积分数大于22%。
(4)根据等效平衡原理,需要满足:n(A)+3n(C)/2=3 n(B)+ n(C)/2=1。
考点:考查了化学平衡移动和计算。

Ⅰ.(4分)在一体积为10L密闭的容器中,通入一定量的CO和H2O(g),在850℃时发生如下反应:CO(g)+H2O(g)  CO2(g)+H2(g) △H<0
CO2(g)+H2(g) △H<0
(1)CO和H2O浓度变化如图,则0~4 min的平均反应速率ν(CO)=_______ mol/(L·min),此时该反应的平衡常数为 。 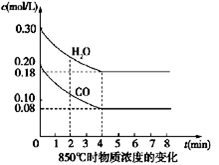
(2)当下列哪些物理量不再发生变化时,表明上述反应已达到平衡状态的是 。
| A.混合气体的压强 |
| B.混合气体的密度 |
| C.CO的物质的量浓度 |
| D.密闭容器中放出热量 |
Ⅱ.(6分)亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。
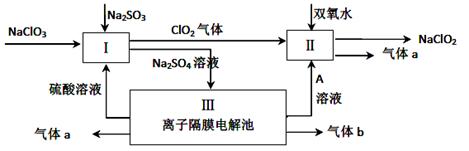
(3)配平Ⅰ中反应方程式 ClO3-+ H++ SO32-== ClO2↑+ SO42-+
(4)A的化学式是 ,。生成气体a的电极反应式 。
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式= 。
(2)该反应为 反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是 (多选扣分)。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为
℃。
铁及其化合物在生产、生活中应用广泛。
(1)一定条件下,Fe与CO2可发生反应:
2Fe(s)+3CO2(g) Fe2O3(s)+3CO(g)
Fe2O3(s)+3CO(g)
该反应的平衡常数(K ) 随温度(T ) 升高而增大。
①该反应的平衡常数K=______。(填表达式)
②下列措施中,能使平衡时c(CO)/c(CO2) 增大的是 (填标号)。
| A.升高温度 | B.增大压强 |
| C.充入一定量CO | D.再加一些铁粉 |
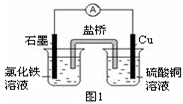
(3)图2装置中甲烧杯盛放100 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5 mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞溶液,观察到石墨电极附近首先变红。
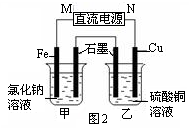
① 电源的M端为 极,甲烧杯中铁电极的电极反应为 。
② 乙烧杯中电解反应的化学方程式为 。
③ 停止电解,取出Cu电极,洗涤、干燥、称量、电极增重 0.64 g,甲烧杯中产生的气体标准状况下体积为 mL 。
甲醇是重要的化工原料和清洁液体燃料。工业上可利用CO或CO2来生产甲醇。甲醇制
备的相关信息如下表: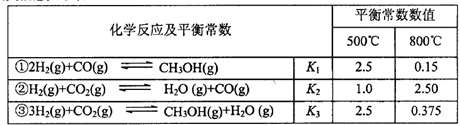
(1)反应②是____反应(选填“吸热”“放热”)。
(2)据上表信息推导出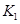 、
、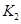 与
与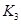 之间的关系,
之间的关系,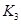 =______用
=______用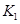 、
、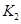 表示)。500℃时测得反应③在某时刻,
表示)。500℃时测得反应③在某时刻,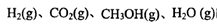 的浓度(mol/L)分别为0 8、0.1、0 3、0 15,此时
的浓度(mol/L)分别为0 8、0.1、0 3、0 15,此时 (选填“>”“<”“=”)。
(选填“>”“<”“=”)。
(3)若某温度下反应①从开始到平衡CO和CH3OH的浓度变化如图一所示,则用H2浓度变化表示此段时间内该反应的平均速.v(H2)= 若某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图二所示,则平衡状态由A变到B时,平衡常数 (选填“>”“<”“=”)。
(选填“>”“<”“=”)。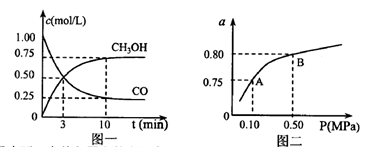
(4)一定温度下,在体积固定的密闭容器中发生反应②,可判断该反应已经达到平衡的是____。(用相应字母表示)
| A.容器中总压强不变 |
| B.混台气体的平均摩尔质量也始终保持不变, |
| C.混合气体的密度不变 |
| D.CO2(g)或CO(g)的浓度不变 |
(1)常温下,将2种一元酸分别和NaOH溶液等体积混合,实验数据如下:
| 组别 | 一元酸 | NaOH | pH |
| 甲 | c(HX)=0.1mol/L | c(NaOH)=0.1mol/L | pH=9 |
| 乙 | c(HY)=c1mol/L | c(NaOH)=0.1mol/L | pH=7 |
①甲组实验的混合溶液中离子浓度由大到小顺序为 。由水电离出的c(OHˉ)= mol/L。
②乙组实验中HY为强酸,则HY溶液的c1 (填“<”、“=”或“>”)0.1。
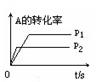
(2)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究小组在实验室以Ag-ZSM-5为催化剂,测得NO转化为N2的转化率随温度变化情况和n(NO)/n(CO)比例变化情况如下图。
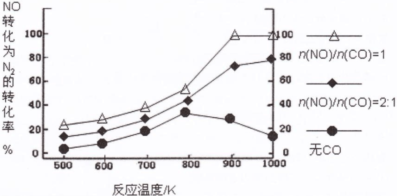
①为达到NO转化为N2的最佳转化率,应该选用的温度和n(NO)/n(CO)比例分别为 、 。
②用CxHy(烃)催化还原NOx也可消除氮氧化物生成无污染的物质。CH4与NO2发生反应的化学方程式为 。
(3)工业上一般在恒容密闭容器中采用下列反应合成甲醇:
CO(g) + 2H2(g)
 CH3OH(g) △H
CH3OH(g) △H下表所列数据是该反应在不同温度下的化学平衡常数(K)。
| 温度 | 523K | 573K | 623K |
| 平衡常数(K) | 2.041 | 0.270 | 0.012 |
①由表中数据判断△H 0(填“<”、“=”或“>”)。
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol/L,则此时的温度为 。
③请在下列坐标中画出②中求得该温度下CO、H2和CH3OH的浓度随时间变化的曲线,并进行适当的标注。
 pC(g)+ qD(g);根据下图示回答:
pC(g)+ qD(g);根据下图示回答: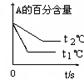
 CH3CH2OH(g)+3H2O(g) -Q(Q>0)
CH3CH2OH(g)+3H2O(g) -Q(Q>0)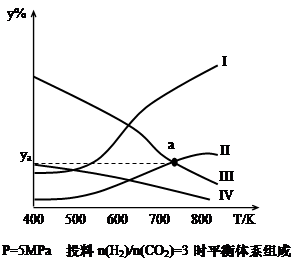
 2C(g)+2D(g) △H,2min末达到平衡,生成0.8mol D。
2C(g)+2D(g) △H,2min末达到平衡,生成0.8mol D。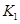 =____________。
=____________。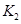 =l,则△H________0(填“>”或“<”)。
=l,则△H________0(填“>”或“<”)。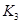 。 则K3________
。 则K3________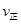 (A)=
(A)=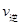 (C) D.混合气体密度不变
(C) D.混合气体密度不变