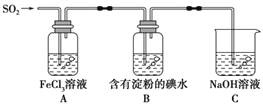
题目内容
【题目】在不同温度下,水溶液中c(H+)与c(OH-)关系如图所示。下列说法不正确的是( )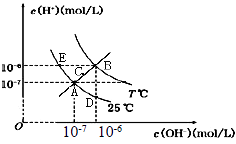
A.图中五点Kw间的关系:B>C>A=D=E
B.E 点对应的水溶液中,可能有NH4+、Ba 2+、Cl-、I-大量同时存在
C.若0.1 mol/L 的NaHA 溶液水溶液中c(H+)与c(OH-)关系如图D 点所示,则溶液中有:c(HA-)>c(OH-)>c(A2- )>c(H2A)
D.向NaHSO4溶液中滴入Ba(OH)2溶液,当c(H+)与c(OH-)关系如图A 点所示,则溶液中反应:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
【答案】C
【解析】A、温度相同Kw相同,温度越高Kw越大,所以图中五点Kw间的关系:B>C>A=D=E,A不符合题意;
B、E点对应的溶液呈酸性,NH4+、Ba2+、Cl-、I-不反应,能大量同时存在,B不符合题意;
C、D 点对应的溶液呈碱性,说明HA-水解大于电离,c(HA-)>c(OH-)>c(H2A)>c(A2-),C符合题意;
D、A 点对应的溶液呈中性,向NaHSO4溶液中滴入Ba(OH)2溶液的关系为2:1,则溶液中反应:2H+ + SO42- + Ba2+ + 2OH- =BaSO4↓+ 2H2O,D不符合题意。答案选C。根据水的离子积常数与温度的关系分析溶液中离子浓度的相对大小关系和发生的离子反应方程式.

 口算能手系列答案
口算能手系列答案【题目】将等物质的量的X、Y气体充入一个容积可变的密闭容器中,在一定条件下发生如下反应并达到平衡:X(g)+Y(g) ![]() 3Z(g) △H<0。当改变某个条件并维持新条件直至达到新平衡,下表中关于新平衡与原平衡的比较,正确的是( )
3Z(g) △H<0。当改变某个条件并维持新条件直至达到新平衡,下表中关于新平衡与原平衡的比较,正确的是( )
选择 | 改变的条件 | 正、逆反应速率变化 | 新平衡和原平衡比较 |
A | 增大压强 | 正、逆反应速率都增大量 | Z的浓度减小 |
B | 充入少量Z | 逆反应速率增大 | X的体积分数不变 |
C | 充入少量Z | v(逆)>v(正) | Z的浓度减小 |
D | 升高温度 | 逆反应速率增大量大于 | Z的体积分数变大 |
A.A
B.B
C.C
D.D