题目内容
【题目】氨对人类的生产生活具有重要影响。
(1)氨的制备与利用。
① 工业合成氨的化学方程式是 。
② 氨催化氧化生成一氧化氮反应的化学方程式是 。
(2)氨的定量检测。
水体中氨气和铵根离子(统称氨氮)总量的检测备受关注。利用氨气传感器检测水体中氨氮含量的示意图如下:
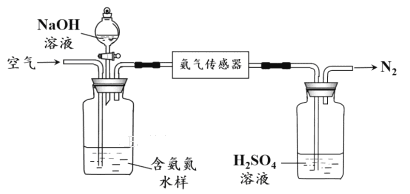
① 利用平衡原理分析含氨氮水样中加入NaOH溶液的作用: 。
② 若利用氨气传感器将1 L水样中的氨氮完全转化为N2时,转移电子的物质的量为6×10-4 mol ,则水样中氨氮(以氨气计)含量为 mg·L-1。
(3)氨的转化与去除。
微生物燃料电池(MFC)是一种现代化氨氮去除技术。下图为MFC碳氮联合同时去除的氮转化系统原理示意图。

① 已知A、B两极生成CO2和N2,写出A极的电极反应式: 。
② 用化学用语简述NH4+去除的原理: 。
【答案】(1)①N2+ 3H2![]() 2NH3 ②4NH3 + 5O2
2NH3 ②4NH3 + 5O2![]() 4NO + 6H2O
4NO + 6H2O
(2)①c(OH-)增大,使NH4++ OH-![]() NH3·H2O
NH3·H2O![]() NH3+ H2O平衡正向移动,利于生成氨气,被空气吹出②3.4
NH3+ H2O平衡正向移动,利于生成氨气,被空气吹出②3.4
(3)①CH3COO-- 8e-+ 2H2O ="==" 2CO2+ 7H+,②NH4+在好氧微生物反应器中转化为NO3-:NH4++ 2O2="==" NO3- + 2H++ H2O;
NO3-在MFC电池正极转化为N2:2NO3- +12H++ 10e- ="==" N2 + 6H2O (2分)
【解析】试题分析:(1)①工业合成氨是利用氮气和氢气催化剂作用下高温高压反应生成氨气,反应的化学方程式为:N2+3H2![]() 2NH3;
2NH3;
②氨气的催化氧化生成一氧化氮和水,反应的化学方程式为:4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
(2)①利用平衡原理分析含氨氮水样中加入NaOH溶液的作用是c(OH-)增大,使NH4++OH-NH3H2ONH3+H2O平衡正向移动,利于生成氨气,被空气吹出;
②将1L水样中的氨氮完全转化为N2时,转移电子的物质的量为6×10-4mol,依据氮元素守恒2NH3~N2~6e-,
2NH3~N2~6e-,
2 6
n 6×10-4mol/L
n=2×10-4mol/L;水样中氨氮(以氨气计)含量=2×10-4mol/L×17g/mol=3.4×10-3g/L=3.4mg/L;
(3)①图示分析可知微生物燃料电池中氢离子移向B电极,说明A为原电池的负极,B为原电池的正极,NO3-离子在正极得到电子生成氮气发生还原反应,CH3COO-在原电池负极失电子生成二氧化碳气体,发生氧化反应,环境为酸性介质,则A极的电极反应式为:CH3COO--8e-+2H2O═2CO2+7H+,B电极反应式为:2NO3-+12H++10e-═N2+6H2O;
②NH4+在好氧微生物反应器中转化为NO3-,NH4++2O2═NO3-+2H++H2O,硝酸根离子在原电池正极发生还原反应生成氮气,2NO3-+12H++10e-═N2+6H2O。

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案【题目】下列提纯物质选用的试剂(或操作)和原理均正确的是
物质(杂质) | 试剂(或操作) | 原理 | |
A A | 乙烯(二氧化硫) | 溴水 | 二氧化硫能与溴水反应 |
B | 溴苯(溴) | 乙醇 | 溴易溶于乙醇 |
C | 正丁醇(乙醚) | 蒸馏 | 正丁醇与乙醚沸点相差较大 |
D | 乙烷(乙烯) | 酸性KMnO4溶液 | 乙烯能与酸性KMnO4溶液反应 |
A.AB.BC.CD.D
【题目】通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一。对下列实验事实解释正确的是( )
选项 | 现象 | 解释 |
A | KI淀粉溶液中通入Cl2,溶液变蓝 | Cl2能与淀粉发生显色反应 |
B | 浓HNO3在光照条件下变黄 | 浓HNO3不稳定,生成有色产物能溶于浓硝酸 |
C | 某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 | 说明该溶液中含有SO |
D | 向盐酸中加入浓硫酸时产生白雾 | 说明浓硫酸具有脱水性 |
A. A B. B C. C D. D



