题目内容
12.根据下图所示的N2(g)和O2(g)反应生成NO(g)过程中的能量变化情况,判断下列说法正确的是( )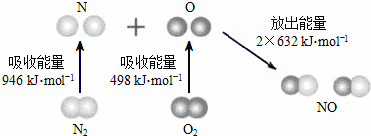
| A. | N2(g)与O2(g)反应生成NO(g)是放热反应 | |
| B. | 2 mol O原子结合生成O2(g)时需要吸收498 kJ能量 | |
| C. | 1 mol NO(g)分子中的化学键断裂时需要吸收632 kJ能量 | |
| D. | N2(g)+O2(g)=2NO(g)的反应热△H=+1444 kJ•molˉ1 |
分析 A、依据焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量,计算分析,焓变为负值是放热反应,焓变是正值是吸热反应;
B、原子结合形成分子的过程是化学键形成过程,是放热过程;
C、依据图示可知形成2molNO放热2×632×J能量,所以1mol NO(g)分子中的化学键断裂时需要吸收632kJ能量;
D、反应焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量.
解答 解:焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量,N2+O2═2NO△H=946kJ/mol+498kJ/mol-2×632kJ/mol=+180kJ/mol,反应是吸热反应;
A、依据计算分析反应是吸热反应,故A错误;
B、原子结合形成分子的过程是化学键形成过程,是放热过程,2mol O原子结合生成O2(g)时需要放出498kJ能量,故B错误;
C、形成2molNO放热2×632×J能量,所以1mol NO(g)分子中的化学键断裂时需要吸收632kJ能量,故C正确;
D、焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量,N2+O2═2NO△H=946kJ/mol+498kJ/mol-2×632kJ/mol=+180kJ/mol,故D错误;
故选C.
点评 本题考查了反应能量变化的计算和判断,反应的焓变计算方法和能量守恒是解题关键,题目难度中等.

练习册系列答案
相关题目
2.在温度不变,恒容的容器中进行反应CO(g)+H2O(g)?H2(g)+CO2(g)△H>0,若反应物的浓度由0.1mol•L-1降到0.06mol•L-1需20s,那么由0.06mol•L-1降到0.036mol•L-1所需反应时间应为( )
| A. | 10 s | B. | 12 s | C. | 大于12 s | D. | 小于12 s |
3.下列说法中正确的是( )
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 任何放热反应在常温条件下一定能够发生 | |
| C. | 总能量大于生成物总能量的反应是吸热反应 | |
| D. | 反应物和生成物所具有的总能量的差决定了化学反应是放热还是吸热反应物 |
20.结构简式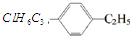 表示的有机物中,能发生消去反应的卤代烃共有( )
表示的有机物中,能发生消去反应的卤代烃共有( )
 表示的有机物中,能发生消去反应的卤代烃共有( )
表示的有机物中,能发生消去反应的卤代烃共有( )| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
7.下列表示物质结构的化学用语或模型正确的是( )
| A. | 二氧化碳的结构式: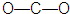 | B. | HF的电子式: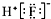 | ||
| C. | Cl-的结构示意图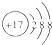 | D. | CH4分子的球棍模型: |
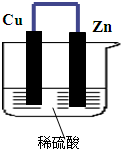 如图所示,将锌、铜通过导线相连,置于稀硫酸中.
如图所示,将锌、铜通过导线相连,置于稀硫酸中.