题目内容
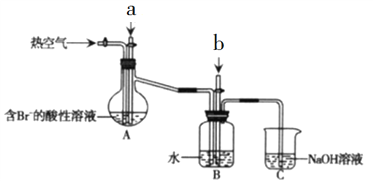
【题目】![]() 是一种易溶于水的微红色斜方晶体,某同学设计下列装置制备硫酸锰:下列说法错误的是( )
是一种易溶于水的微红色斜方晶体,某同学设计下列装置制备硫酸锰:下列说法错误的是( )
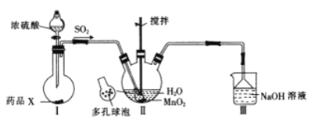
A.装置II中参与反应的氧化剂和还原剂物质的量之比为1:1
B.装置II中用“多孔球泡”可增大![]() 的吸收速率
的吸收速率
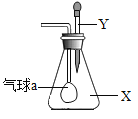
C.装置烧瓶中放入的药品X为铜屑
D.装置Ⅲ中漏斗的作用是防倒吸
【答案】C
【解析】
由实验装置可知,装置Ⅰ用于制取SO2,X应为亚硫酸钠,亚硫酸钠与浓硫酸反应生成二氧化硫,而Cu与浓硫酸常温下不反应;装置II为制备硫酸锰晶体的发生装置,二氧化硫与二氧化锰反应生成MnSO4,使用“多孔球泡”可增大SO2的吸收速率;用装置Ⅱ反应后的溶液经过蒸发浓缩、冷却结晶可得到晶体;装置Ⅲ中NaOH溶液可吸收尾气,以此来解答。
A.根据分析,装置II中MnO2与SO2直接发生氧化还原反应生成MnSO4,反应式为MnO2+SO2=MnSO4,参与反应的氧化剂和还原剂物质的量之比为1:1,故A正确;
B.装置II中用“多孔球泡”,增大了接触面积,可增大![]() 的吸收速率,故B正确;
的吸收速率,故B正确;
C.常温下,Cu不与浓硫酸反应,则X不可能为Cu,应该为亚硫酸钠,故C错误;
D.二氧化硫有毒,需要使用尾气吸收装置,则装置Ⅲ中NaOH溶液用于吸收未反应的二氧化硫,装置中漏斗的作用是防倒吸,故D正确;
答案选C。

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目