题目内容
【题目】镍氢电池是近年来开发出来的可充电电池,它可以取代会产生镉污染的镍镉电池。镍氢电池的总反应是H2+2NiO(OH)![]() 2Ni(OH)2,则下列说法正确的是( )
2Ni(OH)2,则下列说法正确的是( )
A. 电池放电时,H2在正极发生氧化反应
B. 电池工作时,电子从负极经导线流向正极,再由正极经电解质溶液流向负极
C. 正极的电极方程式为NiO(OH)+e-+H2O=Ni(OH)2+OH-
D. 该电池充电放电为可逆反应
【答案】C
【解析】
A.电池放电时,H2在负极上发生氧化反应,负极反应式为:H2-2e-+2OH-=2H2O, A错误;
B.电池工作时,电子从负极经导线流向正极,NiO(OH)在正极上获得电子变为Ni(OH)2、OH-,氢气负极上失去电子变为H2O,电子不可能进入电解质溶液,B错误;
C.正极上NiO(OH)获得电子,正极的电极方程式为NiO(OH)+e-+H2O=Ni(OH)2+OH-,C正确;
D.电池放电与充电的反应条件不同,因此不是可逆反应,D错误;
故合理选项是C。

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
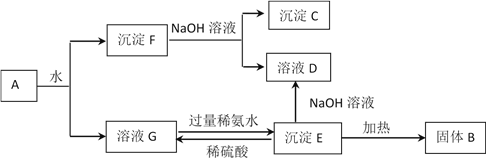
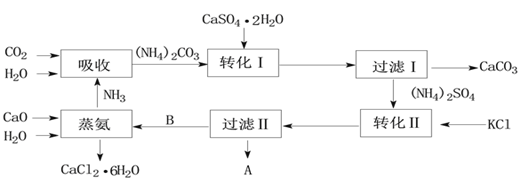
芒果教辅达标测试卷系列答案【题目】下图是某工业生产过程。
溶解度表:
温度℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 | 100 |
氯化铵 | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 55.2 | 65.6 | 71.3 | 77.3 |
硫酸铵 | 70.6 | 73 | 75.4 | 78 | 81 | 88 | 95 | 98 | 103 |
硫酸钾 | 7.4 | 9.3 | 11.1 | 13 | 14.8 | 18.2 | 21.4 | 22.9 | 24.1 |
氯化钾 | 28 | 31.2 | 34.2 | 37.2 | 40.1 | 45.8 | 51.3 | 53.9 | 56.3 |
(1)本工业生产过程的目标产品是____________________________________。(写化学式)
(2)过滤Ⅰ操作所得固体中,除CaCO3外还有一种物质,该固体的用途有_________(试举一例)。
(3)根据溶解度表转化Ⅱ适宜的温度是________
A、0~10℃ B、20~30℃ C、40~60℃ D、90~100℃
过滤Ⅱ操作所得滤渣是__________。
(4)我国著名的化学家也利用了转化Ⅱ的反应原理制备了一种重要的碱,该制备的化学反应方程式为:___________________________________________________
(5)氯化钙结晶水合物(CaCl2·6H2O)进行脱水处理可制得常用的干燥剂,根据下图选择最佳脱水的方法是__________
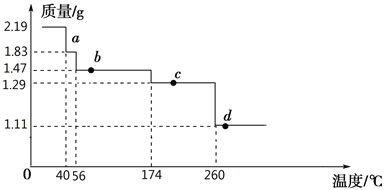
A、氯化氢气流中加热到174℃ B、直接加热至174℃
C、直接加热至260℃ D、氯化氢气流中加热到260℃
(6)上述工业流程实现了绿色化学的理念,其中__________________(填化学式)实现了循环利用,副产品_________________________(填化学式)可转化为原料,整个流程基本实现了污染物零排放。