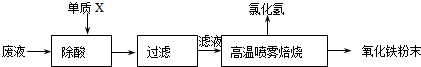
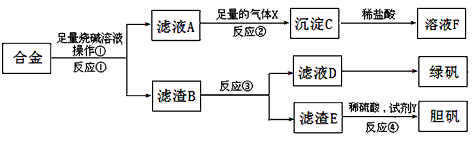
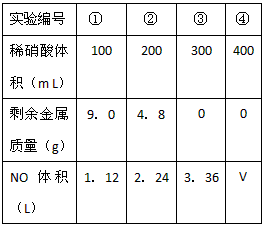
题目内容
标准状况下V L氯化氢气体溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρ g/mL,质量分数为ω,物质浓度为c mol/L,则下列关系中不正确的是( )
分析:A、根据c=
进行公式变形计算ω;
B、对表达式变形可知ρ=
,分子为溶液的质量,分母为溶液的体积,可得该表达式中溶液的体积等于HCl的体积与水的体积之和,据此判断;
C、根据n=
计算HCl的物质的量,再根据m=nM计算HCl的质量,根据m=ρV计算水的质量,进而计算溶液的质量,根据溶质质量分数=
×100%计算;
D、根据n=
计算HCl的物质的量,再根据m=nM计算HCl的质量,根据m=ρV计算水的质量,进而计算溶液的质量,利用V=
计算溶液的体积,再根据c=
计算HCl物质的量浓度.
| 1000ρω |
| M |
B、对表达式变形可知ρ=
| ||
| V+1 |
C、根据n=
| V |
| Vm |
| m(溶质) |
| m(溶液) |
D、根据n=
| V |
| Vm |
| m |
| ρ |
| n |
| V |
解答:解:A、根据c=
可得,ω=
,故A正确;
B、对表达式变形可知ρ=
,分子为溶液的质量,分母为溶液的体积,可得该表达式中溶液的体积等于HCl的体积与水的体积之和,实际溶液的体积不等于气体与水的体积之和,故B错误;
C、HCl的物质的量为
=
mol,HCl的质量为
mol×36.5g/mol=
g,1L水的质量为1000mL×1g/mL=1000g,故HCl质量分数为
×100%=
×100%,故C正确;
D、HCl的物质的量为
=
mol,HCl的质量为
mol×36.5g/mol=
g,1L水的质量为1000mL×1g/mL=1000g,故溶液的质量为(
+1000)g,溶液的体积为
=
L,故所得溶液的物质的量浓度为
=
mol/L,故D正确;
故选B.
| 1000ρω |
| M |
| cM |
| 1000ρ |
B、对表达式变形可知ρ=
| ||
| V+1 |
C、HCl的物质的量为
| VL |
| 22.4L/mol |
| V |
| 22.4 |
| V |
| 22.4 |
| 36.5V |
| 22.4 |
| ||
|
| 36.5V |
| 36.5V+22400 |
D、HCl的物质的量为
| VL |
| 22.4L/mol |
| V |
| 22.4 |
| V |
| 22.4 |
| 36.5V |
| 22.4 |
| 36.5V |
| 22.4 |
(
| ||
| 1000ρ g/L |
| 36.5V+22400 |
| 22400ρ |
| ||
|
| 1000ρV |
| 36.5V+22400 |
故选B.
点评:本题考查物质的量浓度计算、物质的量浓度与质量分数的关系,属于字母型计算,计算量较大,需要学生利用公式细心计算,难度中等.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目