题目内容
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的
| A.NaOH固体 | B.少量硫酸铜固体 | C.H2O | D.少量NaCl固体 |
C
解析试题分析:Fe过量,为了减缓反应速率,且不影响生成氢气的总量,可减小氢离子的浓度,但不能改变氢离子的物质的量,以此来解答。A、加NaOH固体,与盐酸反应,氢离子浓度和氢离子的物质的量均减少,生成氢气减少,故A不符合题意;B、加少量硫酸铜固体,则铁可以置换出铜,从而与铜构成原电池,加快反应速率,故B不符合题意选;C.加水稀释,氢离子的浓度降低,反应速率减小。氢离子的物质的量不变,生成的氢气不变,故C正确;D、加NaCl(s),对反应无影响,反应速率不变,故D不符合题意,D不正确,答案选C。
考点:考查

 教材全解字词句篇系列答案
教材全解字词句篇系列答案某温度下,把3molA和2.5molB混合,盛入容积为2L的容器内,使它们发生反应:
3A(气)+B(气) xC(气)+2D(气)
xC(气)+2D(气)
经过5min后达到平衡生成1mol D , 测得C的平均生成速率为0.10mol·L-1·min-1。下列叙述不正确的是( )
| A.x的值为2 |
| B.B的转化率为20% |
| C.平衡常数为1/3 |
| D.A的平均消耗速率为0.15mol·L-1·min-1 |
合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g) 2NH3(g) ΔH<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
2NH3(g) ΔH<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是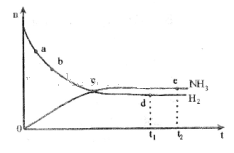
| A.点a的正反应速率比点b的小 |
| B.点c处反应达到平衡 |
C.点d( 时刻)和点e( 时刻)和点e( 时刻)处n( 时刻)处n(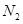 )不一样 )不一样 |
D.其他条件不变,773K下反应至 时刻,n(H2)比上图 时刻,n(H2)比上图 |
在一密闭容器中进行如下反应:2SO2(气)+O2(气) 2SO3(气),已知反应过程中某一时SO2、O2、SO3,的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是
2SO3(气),已知反应过程中某一时SO2、O2、SO3,的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是
| A.SO2为0.4mol/L、O2为0.2mol/L | B.SO3为0.4mol/L |
| C.SO2、S03均为0.15mol/L | D.SO2为0.25mol/L |
下列事实,不能用勒夏特列原理解释的是
| A.新制的氯水在光照下颜色变浅 |
| B.H2、I2、HI平衡混合气加压后颜色变深 |
| C.合成 NH3反应,为提高 NH3的产率,理论上应采取相对较低温度的措施 |
| D.实验室用排饱和食盐水而不用排水法收集氯气 |
把下列4种X的溶液分别加入4个盛有10mL2mol·L-1盐酸的烧杯中,均加水稀释到50 mL,此时X和盐酸缓和地进行反应。其中反应速率最大的是
| A.20mL3mol·L-1的X溶液 | B.20mL2mol·L-1的X溶液 |
| C.10mL4mol·L-1的X溶液 | D.10mL2mol·L-1的X溶液 |
在2升的密闭容器中,反应物的物质的量为3mol,经过20s后,它的物质的量变成了1mol,在这20s内它的反应速率为 ( )
| A.0.1 mol / (L·S) | B.0.05mol /( L·min) |
| C.0.05mol / (L·S) | D.0.8mol / (L·S) |
 2 HBr(g)△H<0,平衡时Br2转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2转化率为b,则a、b的关系是
2 HBr(g)△H<0,平衡时Br2转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2转化率为b,则a、b的关系是