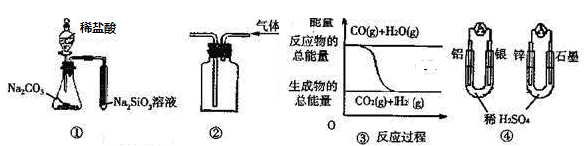
题目内容
现有四种元素的基态原子的电子排布式如下:① 1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p5。则下列有关比较中正确的是
| A.第一电离能:③>②>① | B.原子半径:③>②>① |
| C.电负性:③>②>① | D.最高正化合价:③>②>① |
A
试题分析:由核外电子排布式可知,①1s22s22p63s23p4为S元素,②1s22s22p63s23p3为P元素,③1s22s22p5为F元素,然后根据同周期、同主族的第一电离能、原子半径、电负性的变化规律判断A、B、C选项;最高正化合价等于最外层电子数,注意F、O元素一般没有正化合价。

练习册系列答案
相关题目