题目内容
硝酸工业生产中的尾气(主要成分为NO2和NO)可用纯碱溶液吸收,有关的化学反应为:
2NO2+Na2CO3=NaNO2+NaNO3+CO2↑ ①
NO+NO2+Na2CO3=2NaNO2+CO2↑ ②
(1)用双线桥法表示出反应①中电子转移的方向和数目2NO2+Na2CO3=NaNO2+NaNO3+CO2↑.
(2)配制1000g质量分数为21.2%的纯碱吸收液,需Na2CO3?10H2O多少克?
(3)现有1000g质量分数为21.2%的纯碱吸收液,吸收硝酸工业尾气,每产生22.4L(标准状况)CO2时,吸收液质量增加了44g.计算吸收液中NaNO2和NaNO3的物质的量之比.(写出计算过程)
2NO2+Na2CO3=NaNO2+NaNO3+CO2↑ ①
NO+NO2+Na2CO3=2NaNO2+CO2↑ ②
(1)用双线桥法表示出反应①中电子转移的方向和数目2NO2+Na2CO3=NaNO2+NaNO3+CO2↑.
(2)配制1000g质量分数为21.2%的纯碱吸收液,需Na2CO3?10H2O多少克?
(3)现有1000g质量分数为21.2%的纯碱吸收液,吸收硝酸工业尾气,每产生22.4L(标准状况)CO2时,吸收液质量增加了44g.计算吸收液中NaNO2和NaNO3的物质的量之比.(写出计算过程)
分析:(1)双线桥法是标出化合价升高失去的电子和化合价降低得到电子的方向和数目;
(2)依据溶液中溶质物质的量和结晶水合物物质的量相同,结合摩尔质量计算;
(3)根据化学反应设未知,结合化学方程式的定量关系列方程计算;
(2)依据溶液中溶质物质的量和结晶水合物物质的量相同,结合摩尔质量计算;
(3)根据化学反应设未知,结合化学方程式的定量关系列方程计算;
解答:解:(1)反应①中电子转移的方向和数目,用双线桥法表示为: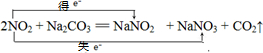 ,
,
答:用双线桥法表示出反应①中电子转移的方向和数目为 ;
;
(2)配制1000g质量分数为21.2%的纯碱吸收液,溶液中溶质碳酸钠物质的量=
=2mol;晶体碳酸钠物质的量也是2mol,
所以m(Na2CO3?10H2O)=2mol×286g/mol=572g,
答:需Na2CO3?10H2O为572g;
(3)1000g质量分数为21.2%的纯碱吸收液,吸收硝酸工业尾气,每产生22.4L(标准状况)CO2时,吸收液质量增加了44g.
①2NO2+Na2CO3=NaNO2+NaNO3+CO2↑△m=48g
NO+NO2+Na2CO3=2NaNO2+CO2↑△m=32g
设由NO2与纯碱反应产生的CO2为amol,
由NO和NO2与纯碱反应产生的CO2为bmol,列方程计算
a+b=1
48a+32b=44
a=0.75mol
b=0.25mol
n(NaNO2):n(NaNO3)=5:3,
答:吸收液中NaNO2和NaNO3的物质的量之比为5:3.
 ,
,答:用双线桥法表示出反应①中电子转移的方向和数目为
 ;
;(2)配制1000g质量分数为21.2%的纯碱吸收液,溶液中溶质碳酸钠物质的量=
| 1000g×21.2% |
| 106g/mol |
所以m(Na2CO3?10H2O)=2mol×286g/mol=572g,
答:需Na2CO3?10H2O为572g;
(3)1000g质量分数为21.2%的纯碱吸收液,吸收硝酸工业尾气,每产生22.4L(标准状况)CO2时,吸收液质量增加了44g.
①2NO2+Na2CO3=NaNO2+NaNO3+CO2↑△m=48g
NO+NO2+Na2CO3=2NaNO2+CO2↑△m=32g
设由NO2与纯碱反应产生的CO2为amol,
由NO和NO2与纯碱反应产生的CO2为bmol,列方程计算
a+b=1
48a+32b=44
a=0.75mol
b=0.25mol
n(NaNO2):n(NaNO3)=5:3,
答:吸收液中NaNO2和NaNO3的物质的量之比为5:3.
点评:本题考查了氧化还原反应的电子转移分析,双线桥表示方法,化学方程式的有关计算方法应用,气体摩尔体积的换算物质的量应用,利用方程式及守恒法的有关计算等,题目难度中等.

练习册系列答案
相关题目