题目内容
【题目】在25℃时,向含有![]() 、
、![]() 的200 mL溶液中加入NaOH固体时,溶液中
的200 mL溶液中加入NaOH固体时,溶液中![]() 、
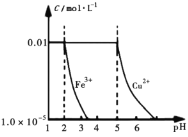
、![]() 随pH的变化曲线如图所示(忽略加人固体时溶液体积的变化)。下列叙述不正确的是( )
随pH的变化曲线如图所示(忽略加人固体时溶液体积的变化)。下列叙述不正确的是( )
A.![]()
B.![]() 时溶液中的阳离子主要为
时溶液中的阳离子主要为![]() 和
和![]()
C.向含有![]() 杂质的
杂质的![]() 溶液中加入CuO或
溶液中加入CuO或![]() 可除去溶液中混有的
可除去溶液中混有的![]()
D.当加入0.03 mol NaOH时,![]() 、
、![]() 完全沉淀
完全沉淀
【答案】B
【解析】
A. ![]() ,
,![]() ,因此
,因此![]() ,故A正确;
,故A正确;
B. 氢离子先反应,因此pH=5时溶液中的阳离子主要为Cu2+,故B错误;
C. 向含有氯化铁杂质的氯化铜溶液中加入CuO或碳酸铜,铁离子水解,氧化铜或碳酸铜与水解生成的氢离子反应,促进水解,因此可除去溶液中混有的铁离子,故C正确;
D. 溶液中氢离子物质的量为0.02mol,铜离子、铁离子物质的量为0.002mol,当加入0.03 mol NaOH时氢离子反应消耗0.02mol氢氧根,剩余0.01mol氢氧根与0.002mol![]() 、0.002mol
、0.002mol![]() 恰好变为沉淀,故D正确。
恰好变为沉淀,故D正确。
综上所述,答案为B。

 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案【题目】部分弱酸的电离常数如下表:
弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
电离常数 (25℃) |
|
|
|
|
(1)同温同物质的量浓度的HCOONa(aq)与NaClO(aq)中pH大的是________。
(2)1molCl2与2molNa2CO3(aq)反应除生成NaCl外还有_______________(填化学式)。
(3)向一定量的NaHCO3(aq)中通入少量的SO2(g),反应的离子方程式为__________。亚硒酸(H2SeO3)也是一种二元弱酸,常温下是一种无色固体,易溶于水,有较强的氧化性。
【题目】25 ℃时有关物质的颜色和溶度积(Ksp)如下表:
物质 | AgCl | AgBr | AgI | Ag2S |
颜色 | 白 | 淡黄 | 黄 | 黑 |
Ksp | 1.8×10-10 | 7.7×10-13 | 1.5×10-16 | 1.8×10-50 |
下列叙述中不正确的是( )
A.向AgCl的白色悬浊液中加入0.1 mol/L KI溶液,有黄色沉淀产生
B.25 ℃时,利用表中的溶度积(Ksp),可以计算AgCl、AgBr、AgI、Ag2S饱和水溶液中Ag+的浓度
C.25 ℃,AgCl固体分别在等物质的量浓度NaCl、CaCl2溶液中溶解达到平衡,两溶液中,c(Ag+)和溶度积均相同
D.在5 mL 1.8×10-6 mol/L NaCl溶液中,加入1滴(20滴约为1 mL)1×10-3 mol/L AgNO3溶液,不能产生白色沉淀