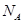题目内容
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A.1 mol羟基与17 g NH3所含电子数都为NA |
| B.12.4 g白磷(分子式为P4)中含有P—P共价键0.6NA |
| C.电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32 g |
| D.适量铜粉溶解于1 L 0.5 mol/L稀硝酸中,当生成2.24 L NO时,溶液中氮原子数为0.4NA |
B
1 mol —OH含电子数为9NA,17 g NH3含电子数为10NA,A项错误;P4是正四面体结构,故12.4 g P4中含P—P键数为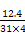 ×6NA=0.6NA,B项正确;电解精炼铜时,粗铜作阳极,在阳极失电子的还有Fe、Zn、Ni等,C项错误;D项中2.24 L NO不一定处在标准状况下,其物质的量就不一定是0.1 mol,错误。
×6NA=0.6NA,B项正确;电解精炼铜时,粗铜作阳极,在阳极失电子的还有Fe、Zn、Ni等,C项错误;D项中2.24 L NO不一定处在标准状况下,其物质的量就不一定是0.1 mol,错误。
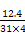 ×6NA=0.6NA,B项正确;电解精炼铜时,粗铜作阳极,在阳极失电子的还有Fe、Zn、Ni等,C项错误;D项中2.24 L NO不一定处在标准状况下,其物质的量就不一定是0.1 mol,错误。
×6NA=0.6NA,B项正确;电解精炼铜时,粗铜作阳极,在阳极失电子的还有Fe、Zn、Ni等,C项错误;D项中2.24 L NO不一定处在标准状况下,其物质的量就不一定是0.1 mol,错误。
练习册系列答案
相关题目
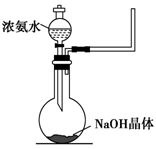
 NH4++OH-,NaOH晶体使该可逆反应的平衡向左移动
NH4++OH-,NaOH晶体使该可逆反应的平衡向左移动