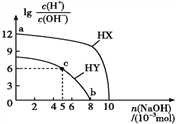
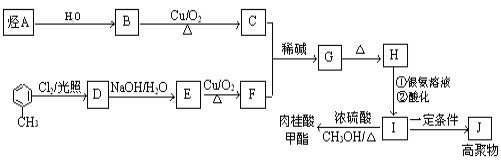
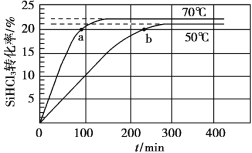
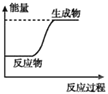
题目内容
【题目】某化工厂利用工业废水M(含有MgSO4、NaCl、MnSO4)为原料制备氮镁磷复合肥MAP,其生成流程如图所示:
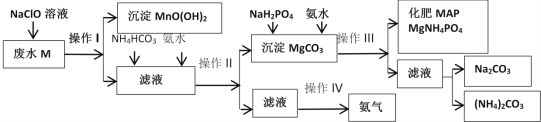
回答下列问题:
(1)实验室中,操作I、II、III为过滤,过滤所需的玻璃仪器有___;若发现滤液浑浊,可能的原因是___;洗涤沉淀的操作是___。
(2)废水M中加入NaClO溶液发生反应的离子方程式为___。
(3)化工生产中,若针对操作IV,欲获得氨气,用于化工生产循环利用,该操作为___。
(4)化肥MAP生产过程中,加入NaH2PO4和氨水,此时氨水的作用是___。
(5)写出操作III中形成化肥MAP的化学反应方程式为___。
【答案】漏斗、烧杯、玻璃棒 滤纸破损(或滤液液面超过滤纸的边缘等) 用玻璃棒引流,向过滤器中注入蒸馏水至浸没沉淀,待水流完后,重复操作2~3遍 ClO-+Mn2++2OH-=MnO(OH)2↓+Cl- 加入生石灰、加热 充当反应物,消耗溶液中的H+,调节溶液的pH 2NaH2PO4+4NH3·H2O+2MgCO3=2MgNH4PO4+Na2CO3+(NH4)2CO3+4H2O
【解析】
由流程知,工业废水M(含有MgSO4、NaCl、MnSO4)中加入NaClO溶液,MnSO4被氧化为MnO(OH)2沉淀,经过滤后分离,所得滤液中含MgSO4、NaCl等,滤液中加入碳酸氢铵和氨水,调 pH产生MgCO3沉淀,经操作Ⅱ即过滤后分离出MgCO3沉淀和滤液,滤液中含铵盐,则操作Ⅳ是把铵盐转变为氨气的过程,而往MgCO3沉淀中加入NaH2PO4和氨水,NaH2PO4呈酸性和MgCO3、氨水发生反应生成化肥MAP,操作Ⅲ的滤液含钠离子、铵离子和碳酸根,可进一步提取出碳酸钠和碳酸铵,据此回答;
(1)过滤所需的玻璃仪器有漏斗、烧杯、玻璃棒;若发现滤液浑浊,可能的原因是滤纸破损(或滤液液面超过滤纸的边缘等);洗涤沉淀的操作是:用玻璃棒引流,向过滤器中注入蒸馏水至浸没沉淀,待水流完后,重复操作2~3遍;
(2)废水M中加入NaClO溶液,发生氧化还原反应,NaClO溶液有强氧化性,把Mn2+氧化了,则反应的离子方程式为ClO-+Mn2++2OH-=MnO(OH)2↓+Cl-;
(3)操作Ⅳ是把铵盐转变为氨气的过程,欲获得氨气,则在加热条件下铵盐需要和强碱反应,那么最价廉物美又来源广泛的,就是加生石灰,故该操作为加入生石灰、加热;
(4)MgCO3沉淀中加入NaH2PO4和氨水,此时氨水的作用是充当反应物,消耗溶液中的H+,调节溶液的pH,以得到MgNH4PO4;
(5)操作III中,NaH2PO4、NH3·H2O和MgCO3反应,得到MgNH4PO4外,还有Na2CO3和(NH4)2CO3等,则该化学反应方程式为:2NaH2PO4+4NH3·H2O+2MgCO3=2MgNH4PO4+Na2CO3+(NH4)2CO3+4H2O。

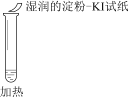
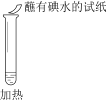
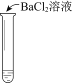
【题目】某同学向SO2和Cl2的混合气体中加入品红溶液,振荡,溶液褪色,将此无色溶液分成三份,依次进行实验,实验操作和实验现象记录如下:
序号 | |||
实验操作 |
|
|
|
实验现象 | 溶液不变红,试纸不变蓝 | 溶液不变红,试纸褪色 | 生成白色沉淀 |
下列实验分析中,不正确的是
A. ①说明Cl2被完全消耗
B. ②中试纸褪色的原因是:SO2 + I2 + 2H2O == H2SO4 + 2HI
C. ③中若将BaCl2溶液换成Ba(NO3)2溶液,也能说明SO2被Cl2氧化为SO42
D. 实验条件下,品红溶液和SO2均被氧化