题目内容
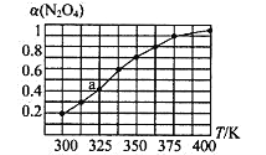
【题目】常温下将盐酸溶液滴加到联氨(N2H4)的水溶液中,混合溶液中的微粒的物质的量分数δ(X)随-1g(OH-)变化的关系如图所示。下列叙述错误的是
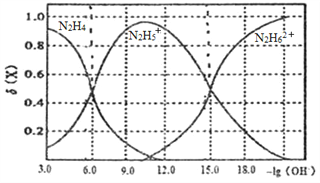
A. 反应N2H62++N2H4=2N2H5+的pK=90(已知pK=-lgK)
B. N2H5Cl溶液中存在:c(Cl-)+c(OH-)=c(N2H5+)+2c(N2H62+)+c(H+)
C. N2H5Cl溶液中c(H+)>c(OH-)
D. Kb1(N2H4)=10-6
【答案】A
【解析】
A.根据电离平衡常数概念结合图像计算;
B.根据电荷守恒分析;
C.根据N2H5+水解分析;
D. 根据电离平衡常数概念结合图像计算。
A、由N2H5+的电离方程式N2H5++H2O![]() N2H62++OH-可得Kb2(N2H4)=
N2H62++OH-可得Kb2(N2H4)=![]() ,则Kb1(N2H4)/Kb2(N2H4)=
,则Kb1(N2H4)/Kb2(N2H4)=![]() ,即为反应N2H62++N2H4=2N2H5+的K=Kb1(N2H4)/Kb2(N2H4)=
,即为反应N2H62++N2H4=2N2H5+的K=Kb1(N2H4)/Kb2(N2H4)=![]() ,所以pK= -9.0,A错误;
,所以pK= -9.0,A错误;
B、N2H5C1溶液中存在的电荷守恒为c(Cl-)+c(OH-)=c(N2H5+)+2c(N2H62+)+c(H+),B正确。
C、N2H5C1溶液中因N2H5+的水解使溶液呈酸性,所以c(H+)>c(OH-),C正确;
D、由图象可知当-lg(OH-)=6时,N2H4和N2H5+的物质的量分数相等,可推知其浓度相等,由N2H4的电离方程式N2H4+H2O![]() N2H5++OH-,得Kb1(N2H4)=
N2H5++OH-,得Kb1(N2H4)=![]() ,D正确;答案选A。
,D正确;答案选A。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目