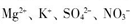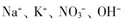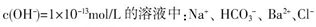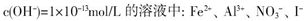题目内容
将足量CO2通入下列溶液中,所含离子还能大量共存的是( )
| A.K+、SiO32-、Cl-、NO3- |
| B.H+、NH4+、Al3+、SO42- |
| C.Na+、S2-、OH-、SO42- |
| D.Na+、CO32-、CH3COO-、HCO3- |
B
解析

练习册系列答案
相关题目
在加入铝粉能放出H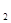 的溶液中,下列各组离子一定不能大量共存的是( )
的溶液中,下列各组离子一定不能大量共存的是( )
A.Na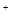 、Fe 、Fe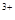 、SO 、SO 、Cl 、Cl |
B.Ba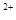 、Mg 、Mg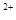 、HCO 、HCO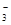 、NO 、NO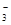 |
C.Na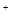 、K 、K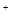 、NO 、NO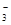 、CO 、CO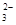 |
D.K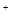 、NO 、NO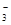 、AlO 、AlO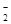 、OH 、OH |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.与Al反应放出H2的溶液:Mg2+、Ca2+、HCO3-、NO3- |
| B.10 mol·L-1的浓氨水:Al3+、NH4+、NO3-、I— |
| C.0.1 mol·L-1KMnO4溶液:Na+、Fe2+、SO42-、Cl— |
| D.c(H+)/c(OH—)=1×10—12的溶液:K+、Na+、AlO2—、CO32— |
某废水中可能存在的离子如下:Na+、Ag+、Ba2+、Al3+、AlO2一、CO32-、S2一、SO32-、SO42-
现取该溶液进行有关实验,实验过程及现象如下: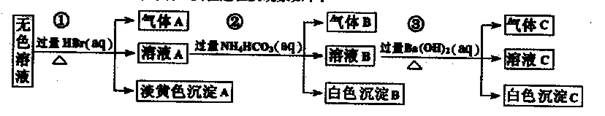
下列说法正确的是
| A.根据实验①中的现象可推出,气体A一定是纯净物,淡黄色沉淀一定是AgBr |
| B.根据实验②中的现象可推出,气体B是CO2,沉淀B是Al(OH)3,原溶液中一定含有Al3+ |
| C.根据实验③中的现象可推出,气体C是NH3,沉淀C一定有BaCO3,可能有BaSO4 |
| D.原溶液中肯定含有Na+、AlO2-、S2-,不能确定是否含有SO32-、SO42- |
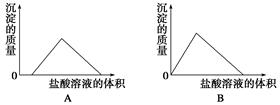
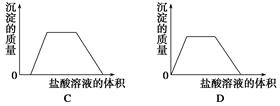
下列图示与对应的叙述相符的是( )
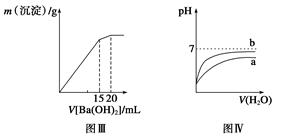
| A.图Ⅰ表示常温下盐酸滴加到0.1 mol·L-1某碱溶液中得到的滴定曲线,由图Ⅰ可知二者恰好中和时,所得溶液的pH>7 |
B.图Ⅱ表示一定条件下进行的反应2SO2+O2 2SO3 ΔH<0各成分的物质的量变化,t2时刻改变的条件可能是升高温度 2SO3 ΔH<0各成分的物质的量变化,t2时刻改变的条件可能是升高温度 |
| C.图Ⅲ表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20 mL Ba(OH)2溶液时,沉淀全部是BaSO4 |
| D.图Ⅳ表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线a对应的是盐酸 |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A.1.0 mol·L-1 KNO3溶液:H+、Fe2+、SCN-、SO42- |
| B.c(H+)/c(OH-)=10-10的溶液:K+、Ba2+、NO3-、Cl- |
| C.pH=0的溶液:Al3+、Ag(NH3) 2-、Cl-、SO42- |
| D.c(ClO-)=1.0 mol·L-1的溶液:Na+、SO32-、S2-、SO42- |
下列现象描述、化学方程式或离子方程式和反应类型都正确的是( )
| 选项 | 操作方法 | 主要现象 | 化学方程式或离子方程式 | 反应 类型 |
| A | 氢气在氯气中燃烧 | 蓝色 火焰 | H2+Cl2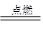 2HCl 2HCl | 化合 反应 |
| B | SO2通入硝酸 钡溶液中 | 产生白色沉淀 | Ba(NO3)2+SO2+H2O= BaSO3↓+2HNO3 | 复分解反应 |
| C | 常温下,足量 的Cl2通入 FeBr2溶液中 | 浅绿色变黄色 | 2Fe2++Cl2=2Fe3++2Cl- | 氧化还原反应 |
| D | 硫化氢通 入碘水中 | 颜色变浅产生 淡黄色固体 | H2S+I2=S↓+2HI | 氧化还原反应 |