题目内容
5.在一定温度下将2molA和2molB两种气体混合于2L密闭容器中,发生如下反应:3A(g)+B(g)?2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8mol D,请填写下面空白.(1)B的平衡浓度为0.8mol/L.
(2)A的转化率为60%.
(3)用D表示的平均反应速率为0.2mol/(L•min).
(4)如果缩小容器容积(温度不变),则平衡体系中混合气体的密度增大,平均相对分子质量不变.(两空均填“增大、“减少”或“不变”)
分析 在一定温度下将2molA和2molB两种气体混合于2L密闭容器中,2分钟末反应达到平衡状态,生成了0.8mol D,则:
3A(g)+B(g)?2C(g)+2D(g)
起始量(mol):2 2 0 0
变化量(mol):1.2 0.4 0.8 0.8
平衡量(mol):0.8 1.6 0.8 0.8
(1)根据c=$\frac{n}{V}$计算B的平衡浓度;
(2)A的转化率=$\frac{△n(A)}{A的起始物质的量}$×100%;
(3)根据c=$\frac{\frac{△n}{V}}{△t}$计算v(D);
(4)反应混合物都为气体,总质量不变,体积减小,平衡体系中混合气体的密度增大;
该反应反应前后气体体积不变,气体总质量不变,平均摩尔质量不变,平均相对分子质量不变.
解答 解:在一定温度下将2molA和2molB两种气体混合于2L密闭容器中,2分钟末反应达到平衡状态,生成了0.8mol D,则:
3A(g)+B(g)?2C(g)+2D(g)
起始量(mol):2 2 0 0
变化量(mol):1.2 0.4 0.8 0.8
平衡量(mol):0.8 1.6 0.8 0.8
(1)B的平衡浓度=$\frac{1.6mol}{2L}$=0.8mol/L,故答案为:0.8mol/L;
(2)A的转化率=$\frac{1.2mol}{2mol}$×100%=60%,故答案为:60%;
(3)v(D)=$\frac{\frac{0.8mol}{2L}}{2min}$=0.2mol/(L•min),故答案为:0.2mol/(L•min);
(4)反应混合物都为气体,总质量不变,体积减小,平衡体系中混合气体的密度增大;
该反应反应前后气体体积不变,气体总质量不变,平均摩尔质量不变,平均相对分子质量不变,
故答案为:增大;不变.
点评 本题考查化学平衡有关计算,比较基础,注意三段式解题法在化学平衡计算中应用.

 备战中考寒假系列答案
备战中考寒假系列答案
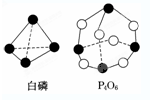
| A. | 该元素的原子中中子数为15 | B. | 该元素的一个核素的质量数为15 | ||
| C. | 该元素的相对原子质量为30.97 | D. | 该元素所有同位素都含有15个质子 |

 (1)1mol乙烷在氧气中完全燃烧生成二氧化碳和液态水,放出热量1558.3kJ,写出乙烷燃烧的热化学方程式C2H6(g)+$\frac{7}{2}$O2(g)═2CO2(g)+3H2O(l)△H=-1558.3KJ/mol;
(1)1mol乙烷在氧气中完全燃烧生成二氧化碳和液态水,放出热量1558.3kJ,写出乙烷燃烧的热化学方程式C2H6(g)+$\frac{7}{2}$O2(g)═2CO2(g)+3H2O(l)△H=-1558.3KJ/mol;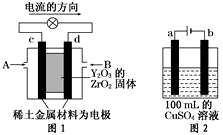 (1)“天宫一号”于2011年9月在酒泉卫星发射中心发射,标志着我国的航空航天技术迈进了一大步.火箭的第一、二级发动机中,所用的燃料为偏二甲胼和四氧化二氮,偏二甲肼可用胼来制备.
(1)“天宫一号”于2011年9月在酒泉卫星发射中心发射,标志着我国的航空航天技术迈进了一大步.火箭的第一、二级发动机中,所用的燃料为偏二甲胼和四氧化二氮,偏二甲肼可用胼来制备. 以CH4和H2O为原料,通过下列反应来制备甲醇.
以CH4和H2O为原料,通过下列反应来制备甲醇.