题目内容
10.铁、铜混合粉末18.0g加人到100m1 5.0mol/L FeC13溶液中,剩余固体质量为3.2g,下列说法正确的是( )| A. | 剩余固体是铁、铜混合物 | |
| B. | 原固体混合物中铜的质量是6.4g | |
| C. | 反应后溶液中n(Fe3十)=0.l0mol | |
| D. | 反应后溶液中n(Fe2十)+n(Cu2十)=0.75mo1 |
分析 A.铁的还原性强于铜,把铁、铜混合粉末加入氯化铁溶液中,先后发生:Fe+2Fe3+=3Fe2+、Cu+2Fe3+=Cu2++2Fe2+,溶液中n(FeCl3)=5mol/L×0.1L=0.5mol,计算0.5mol铁离子完全反应,分别消耗Cu、Fe的质量,再根据参加反应的金属质量判断剩余固体的组成;
B.列方程计算参加反应的Cu、Fe物质的量,原固体混合物中Cu的质量=参加反应Cu的质量+剩余固体Cu的质量;
C.金属有剩余,则Fe3+完全反应;
D.反应后溶液为FeC12、CuC12溶液,根据电荷守恒可知:n(Fe2+)+n(Cu2+)=$\frac{1}{2}$n(Cl-).
解答 解:A.铁的还原性强于铜,把铁、铜混合粉末加入氯化铁溶液中,先后发生:Fe+2Fe3+=3Fe2+、Cu+2Fe3+=Cu2++2Fe2+,溶液中n(FeCl3)=5mol/L×0.1L=0.5mol,
设0.5mol铁离子完全反应消耗Cu、Fe的质量分别为m1、m2,则:
Cu+2Fe3+=Cu2++2Fe2+ Fe+2Fe3+=3Fe2+
64g 2mol 56g 2mol
m1 0.5mol m2 0.5mol
m1=$\frac{64g×0.5mol}{2mol}$=16g,
m2=$\frac{56g×0.5mol}{2mol}$=14g,
溶解的金属质量是18-3.2=14.8,则两种金属都参与反应,Fe3+完全反应,剩余的金属是铜,故A错误;
B.设反应的铜的物质的量是n1 mol,反应的铁物质的量为n2mol,则:
64n1+56n2=14.8
2n1+2n2=0.5
解得:n1=0.1,n2=0.15,
则原来含有的铜的质量是:0.1mol×64g/mol+3.2g=9.6g,故B错误;
C.金属有剩余,则Fe3+完全反应,反应后溶液中没有Fe3+,故C错误;
D.反应后溶液为FeC12、CuC12溶液,根据电荷守恒可知:n(Fe2+)+n(Cu2+)=$\frac{1}{2}$n(Cl-)=$\frac{0.5mol×3}{2}$=0.75mol;
故选:D.
点评 本题考查混合物的计算,侧重于学生的分析能力和计算能力的考查,关键是明确发生反应先后顺序及判断反应剩余固体组成,难度中等.

 字词句段篇系列答案
字词句段篇系列答案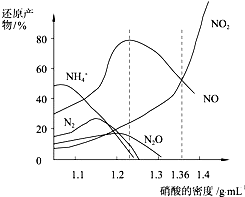
| A. | 密度小于1.1g/mL的硝酸与金属反应,还原产物主要是NH4+ | |
| B. | 当硝酸溶液的密度为1.36g/mL时,Fe与过量硝酸反应的化学方程式为:4Fe+18HNO3=4Fe(NO3)3+3NO+3NO2+9H2O | |
| C. | 稀硝酸与金属反应,一定被还原成NO | |
| D. | 某硝酸试剂瓶的标签注明:密度1.26g/mL,质量分数50.0%;若取该试剂10mL配成1000mL溶液,所得溶液的物质的量浓度为1 mol/L |
| A. | 油脂发生皂化反应能生成甘油 | |
| B. | 蔗糖水解前后均可发生银镜反应 | |
| C. | Fe、Cu、Ag三种金属常用化学还原剂还原法制得 | |
| D. | 向蛋白质溶液中加入CuSO4溶液发生盐析 |
| A. | 8.71g | B. | 8.86g | C. | 9.06g | D. | 7.04g |

| A. | 该物质属于烃类 | B. | 该物质易溶于水 | ||
| C. | 该物质能使酸性高锰酸钾溶液褪色 | D. | 该物质是一种高分子化合物 |
| A. | 衣料中的蚕丝和涤纶都属于合成有机高分子材料 | |
| B. | 加碘食盐和铁强化酱油都可以补充人体必需的微量元素 | |
| C. | 建筑高楼大厦时用到的钢是纯净物 | |
| D. | 用液化石油气代替汽油作汽车燃料,不会造成空气污染 |
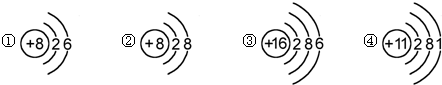
| A. | ①和②属同种元素 | B. | ②属于稀有气体元素 | ||
| C. | ①和③的化学性质相似 | D. | ④属于金属元素 |
| A. | 常温常压下,6gO2和26gO3混合气体中的原子总数为2NA | |
| B. | 100mL 0.1mol/L的NaCl溶液中,所含微粒总数为0.02NA | |
| C. | 23g金属钠变为钠离子时得到的电子数为NA | |
| D. | 标准状况下,2.24LH2O所含的原子数为0.3NA |
| A. | c(NH4+)相等的(NH4)2SO4溶液、NH4HSO4溶液和NH4Cl溶液中,溶质浓度大小关系是:c[(NH4)2SO4]<c[(NH4HSO4]<c(NH4Cl) | |
| B. | 欲除去CuCl2溶液中混有少量的FeCl3,可加入CuO | |
| C. | 0.2mol/L HCl溶液与等体积0.05mol/L Ba(OH)2溶液混合后,溶液的pH=1 | |
| D. | 0.2mol/L的NaHCO3溶液中c(H+)+c(H2CO3)=c(CO32-)+c(OH-) |