��Ŀ����
����Ŀ����ͼ�����ֳ����л���ı���ģ�ͣ���ش��������⣺
(1)���Ľṹ��ʽ��_____________��
(2)���������У���������ɫ����������ζ���ж�Һ�壬�Ҳ�����ˮ���ܶȱ�ˮС�������м�����ˮ�����ú۲쵽��������______________��
(3)д����һ�������£��ҷ����ۺϷ�Ӧ���ɸ߷��ڻ�����Ļ�ѧ����ʽ________��
(4)���Ϊͬϵ������ʾ�����ͨʽCnH2n+2����n=6ʱ�����л�����___��ͬ���칹�壬����̼����̵�ͬ���칹��Ľṹ��ʽ��________________��__________��
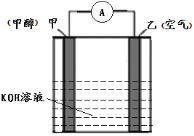
(5)�ü���ȼ�ϵļ���ȼ�ϵ���У��缫����Ϊ������Խ����缫�����ĵ缫��ӦʽΪ_________��
���𰸡� CH3CH2OH Һ��ֲ㣬�ϲ�Ϊ��ɫ���²�Ϊ��ɫ ![]() 5 ��CH3��2CHCH��CH3��2 ��CH3��3CCH2CH3 CH4+10OH����8e��=CO32��+7H2O
5 ��CH3��2CHCH��CH3��2 ��CH3��3CCH2CH3 CH4+10OH����8e��=CO32��+7H2O
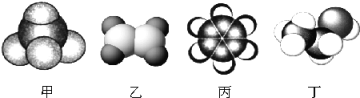
�������������ֳ����л���ı���ģ��ʾ��ͼ��֪����Ϊ���飬��Ϊ��ϩ����Ϊ������Ϊ�Ҵ�������л���Ľṹ�����������
��1�������Ҵ����ṹ��ʽ�ֱ�ΪCH3CH2OH��
��2����������ֻ�б�����ɫ����������ζ���ж�Һ�壬�Ҳ�����ˮ���ܶȱ�ˮС�����������л��ܼ����������м�����ˮ�����ú۲쵽��������Һ��ֲ㣬�ϲ�Ϊ��ɫ���²�Ϊ��ɫ��
��3����ϩ����̼̼˫�����ܷ����Ӿ۷�Ӧ������ϩ�����ۺϷ�Ӧ���ɸ߷��ӻ�����Ļ�ѧ����ʽΪ![]() ��
��
��4����n=6ʱ�����л���ΪC6H14����CH3CH2CH2CH2CH2CH3����CH3��2CHCH2CH2CH3��CH3CH2CH��CH3��CH2CH3����CH3��2CHCH��CH3��2����CH3��3CCH2CH3����5��ͬ���칹�壬����̼����̵�ͬ���칹��Ľṹ��ʽ�ǣ�CH3��2CHCH��CH3��2����CH3��3CCH2CH3��
��5�����Ե������Һ�м���ʧȥ��������̼������ӣ����ĵ缫��ӦʽΪCH4+10OH����8e��=CO32��+7H2O��