题目内容
某红色固体的成分可能是氧化亚铜、铜或三氧化二铁中的一种或几种。某学校化学科研小组欲探究该红色固体的成分。请你参与该活动,并完成相关实验设计。
查资料知道,氧化亚铜是一种碱性氧化物,溶于稀硫酸生成铜和硫酸铜,在空气中加热生成氧化铜。
(1)甲同学认为,取少量固体,加入足量稀硫酸,充分搅拌后,取该溶液少量,置于一洁净的试管中,滴加硫氰化钾溶液,如溶液不变红色,证明原固体中一不定期不含三氧化二铁。你认为这种说法合理吗? 。简述你的理由(不需写出反应的方程式): 。
(2)乙同学认为,取少量固体溶液稀硫酸,若固体全部溶解,就说明一定没有铜和氧化亚铜。这种说法不合理。在此实验过程中,可能发生如下反应(用离子方程式表示):
。
(3)丙同学经分析确定该固体的成分是氧化亚铜和铜。他想通过实验测定两种物质的质量分数。请你帮他设计一个实验方案,写出实验涉及到反应的化学方程式:以a、b、c……代表实验测出相应的数据,写出氧化亚铜的质量分数的表达式。
化学方程式: 。
氧化亚铜的质量分数的表达式: 。
(1)不合理 因为Fe3+能与Cu反应转化为Fe2+,Fe2+与SCN―反应不变红色
(2)Fe2P3+6H+=2Fe3++3H2O, Cu2O+2H+=Cu+Cu2++H2O,
2Fe3++Cu=2Fe2++Cu2+
(3)方案一:Cu2O+H2SO4![]() Cu+CuSO4+H2O
Cu+CuSO4+H2O
w%=[9(a-b)/5a]×100%
方案二:Cu2O+H2![]() 2Cu+H2O w%=[9(a-b)/a]×100%
2Cu+H2O w%=[9(a-b)/a]×100%
方案三:2Cu2O+O2![]() 4CuO 2Cu2O+O2
4CuO 2Cu2O+O2![]() 2CuO
2CuO
w%=[(45a-36b)/5a]×100%
(以上方案及其他合理答案均可得分)

 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案(一)查阅资料
资料1:乙醇不与氢氧化钠或硫酸亚铁反应;乙醇与水互溶,氢氧化钠能溶于乙醇;硫酸亚铁在乙醇中的溶解度比在水中的溶解度小.氮气不能与铜反应.
资料2:几种含铁物质的颜色
| 化学式 | Fe | FeO | Fe2O3 | Fe3O4 | Fe(OH)2 | Fe(OH)3 |
| 颜色 | 银白色 | 黑色 | 红色 | 黑色 | 白色 | 红褐色 |
①取少量的新制硫酸亚铁晶体于大试管中,向其中加入5mL热蒸馏水,使之充分溶解,然后向其中慢慢加入10mL无水乙醇,这时会发现溶液中有小气泡逸出,静置,直到无小气泡冒出为止.
②另取一支试管,向其中加入半药匙固体氢氧化钠,然后向其中加入5mL无水乙醇,充分溶解后静置.
③用长胶头滴管吸取新配制的氢氧化钠的乙醇溶液,伸入硫酸亚铁溶液中,慢慢地挤压橡胶头,连续吸取几次,使之充分反应,静置片刻,这时在试管底会有大量的白色凝乳状溶胶沉降.
④小心地倒去上层溶液,再向试管中加入3mL无水乙醇洗涤,连续洗涤两三次,这时白色的凝乳状溶胶会变成白色固体,然后倒在滤纸上使乙醇充分挥发,便得到白色固体粉末.
(1)为避免硫酸亚铁在溶于水的过程中被氧化,通常可以向溶液中加入
(2)预测上述白色固体的成分可能是
(3)写出生成白色沉淀的化学方程式:
(三)探究产物成分
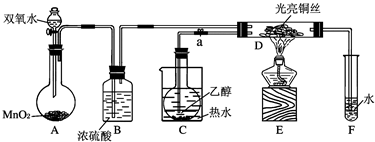
Ⅰ利用如图所示装置检验白色粉末的性质:
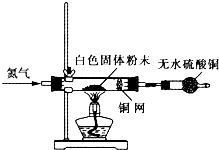
先通入氮气排尽装置内的空气后,继续通入氮气,然后加热硬质试管,观察到无水硫酸铜逐渐变成蓝色;硬质试管里的白色固体粉末逐渐变成黑色;铜网没有明显的颜色变化.当白色固体粉末全部变成黑色粉末时,停止加热,继续通入氮气至硬质试管冷却.
Ⅱ.待冷却后,取适量黑色粉末溶于少量的稀盐酸中,黑色粉末溶解,溶液呈浅绿色,不产生气泡.
Ⅲ.取Ⅱ中的溶液于试管中,滴加酸性高锰酸钾溶液,溶液的紫色褪去.
(4)实验1中,氮气的作用是
(5)证明白色固体粉末中含有+2价铁的实验现象为
属于分解反应的化学方程式:
(6)某同学在上述实验的基础上,增加了一个实验确认白色固体中不含+3价铁,设计的实验可能是