题目内容
(14分)为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,主要流程如下:
部分含钒物质在水中的溶解性如下:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
⑴工业由V2O5冶炼金属钒常用铝热剂法,写出该反应的化学方程式 。
⑵图中所示滤液中含钒的主要成分为 (写化学式)。
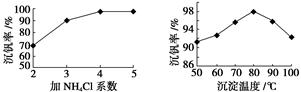
⑶该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,该步反应的离子方程式 ;沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据下图判断最佳控制氯化铵系数和温度为 、 。
⑷用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量,完成反应的离子方程式为□VO2++□H2C2O4+□_____=□VO2++□CO2↑+□H2O。
⑸全矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为VO2++V2++2H+
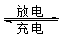 VO2++H2O+V3+,电池充电时阳极的电极反应式为 。
VO2++H2O+V3+,电池充电时阳极的电极反应式为 。
⑴ 3V2O5+10Al 5Al2O3+6V;⑵VOSO4; ⑶ NH4++VO3—=NH4VO3↓; 4;80℃ ;
5Al2O3+6V;⑵VOSO4; ⑶ NH4++VO3—=NH4VO3↓; 4;80℃ ;
⑷ 2VO2++H2C2O4+2H+ = 2VO2++2CO2↑+2H2O ⑸ VO2++H2O-e-=VO2++2H+
解析试题分析:⑴用V2O5通过铝热反应制取V的方程式为:3V2O5+10Al 5Al2O3+6V。⑵根据流程图及题目提供的物质的溶解性信息可知:在图中所示滤液中含钒的主要成分为VOSO4;⑶向含有VO3—的溶液中加入NH4Cl,发生反应得到NH4VO3沉淀的两种方程式是NH4++VO3—=NH4VO3↓;由于在氯化铵系数是4、反应温度为80℃时沉钒率最高。因此最佳控制氯化铵系数和温度为4;80℃。⑷根据电子守恒、电荷守恒及元素的原子个数守恒可知缺项为H+,相应的两种方程式是2VO2++H2C2O4+2H+ = 2VO2++2CO2↑+2H2O;⑸根据全矾液流电池在充电时的工作原理方程式可知: 电池充电时阳极的电极反应式为VO2++H2O-e-=VO2++2H+。
5Al2O3+6V。⑵根据流程图及题目提供的物质的溶解性信息可知:在图中所示滤液中含钒的主要成分为VOSO4;⑶向含有VO3—的溶液中加入NH4Cl,发生反应得到NH4VO3沉淀的两种方程式是NH4++VO3—=NH4VO3↓;由于在氯化铵系数是4、反应温度为80℃时沉钒率最高。因此最佳控制氯化铵系数和温度为4;80℃。⑷根据电子守恒、电荷守恒及元素的原子个数守恒可知缺项为H+,相应的两种方程式是2VO2++H2C2O4+2H+ = 2VO2++2CO2↑+2H2O;⑸根据全矾液流电池在充电时的工作原理方程式可知: 电池充电时阳极的电极反应式为VO2++H2O-e-=VO2++2H+。
考点:考查化学方程式、两种方程式、电解池的电极式的书写、反应条件的选择及物质的想知道应用。

 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案电池是人类生产和生活中的重要能量来源,各式各样电池的发明是化学对人类的一项重大贡献。下列有关电池的叙述正确的是( )
| A.锌锰干电池工作一段时间后碳棒变细 |
| B.氢氧燃料电池可将热能直接转变为电能 |
| C.氢氧燃料电池工作时氢气在负极被氧化 |
| D.太阳能电池的主要材料是高纯度的二氧化硅 |
工业上电解制碱的技术是用阳离子交换膜法,主要原料是饱和食盐水。下图为阳离子交换膜法电解原理示意图:
请回答下列问题: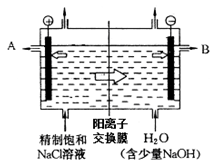
(1)A极为电解槽的________极,B极的材料工业上常采用的是生活中常见的金属,但有大量损耗,其主要原因是 。(填“吸氧腐蚀”或“析氢腐蚀”)
(2)电解槽中部的阳离子交换膜把电解槽隔成了阴极室和阳极室,这种阳离子交换膜,只允许溶液中的__________通过(填写下列微粒的编号)。
①H2,②Cl2,③H+,④Cl-,⑤Na+,⑥OH-。
(3)若上述电解过程中用阴离子交换膜代替阳离子交换膜(已知:3Cl2 +6OH-==5Cl-+ClO3-+3H2O),下列说法正确的组合是 。
| A.电解结束时,右侧溶液中含有ClO3— |
B.电解槽内发生反应的总化学方程式为:NaCl + 3H2O  NaClO3 + 3H2↑ NaClO3 + 3H2↑ |
| C.用阴离子交换膜后,电解槽内两个电极发生的电极反应与原来一样 |
| D.用阴离子交换膜后,阳离子的定向移动方向与原来相反 |
 4LiCl +S+SO2。
4LiCl +S+SO2。


